
【题目】我国规定:室内甲醛含量不得超过0.08mg·m-3。某研究性学习小组欲利酸性KMnO4溶液测定空气中甲醛的含量, (部分装置如图),其反应原理及步骤如下:
4MnO4-+5HCHO+H +=Mn2++5CO2↑+11H2O
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O

步骤:①量取5.00mL 1.00×10-3mol·L-1 KMnO4,溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释备用。
②取1.00×10-3mol·L-1草酸标准溶液于酸式滴定管中备用。
③用注射器抽取100mL新装修室内空气。再将注射器气体推入洗气瓶中充分反应。再重复4次。
④将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积。
⑤再重复实验2次(每次取高锰酸钾溶液5.00mL)。3次实验消耗草酸溶液的体积平均值为12.38mL。
回答下列问题
(1)此实验用指示剂____________(填字母)。A 甲基橙 b酚酞 c淀粉 d无需另外添加试剂
(2)量取5.00mL KMnO4溶液应用______________滴定管
(3)下列操作能引起室内甲醛浓度偏高的是________。
a.滴定终点俯视读数 b.滴定前有气泡滴定后无气泡
c.在高锰酸钾溶液中加入少量水 d.装草酸的滴定管未润洗
(4)草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,如果向10 mL 0.01 molL-1 H2C2O4溶液中滴加0.0 1 molL-1 NaOH溶液
①当加入的NaOH溶液体积为10 mL,请你写出溶液中质子守恒关系式__________。
②当加入的NaOH溶液体积为20 mL,请你写出溶液中离子的浓度大小关系__________。
【答案】d 酸式 a c(H+)+ c(H2C2O4)= c(OH-)+ c(C2O42-) c( Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)
【解析】
本题考查实验方案设计与评价,(1)高锰酸钾本身显紫色或紫红色,因此本实验无需指示剂;(2)高锰酸钾溶液具有强氧化性,因此用酸式滴定管量取高锰酸钾;(3)根据设计的原理,与甲醛反应高锰酸钾的物质的量为(VKMnO4×cKMnO4-VH2C2O4×cH2C2O4×2/5)mol,则甲醛的物质的量为(VKMnO4×cKMnO4-VH2C2O4×cH2C2O4×2/5)×5/4mol,a、滴定终点俯视读数,读出的VH2C2O4偏小,则所测甲醛浓度偏高,故a正确;b、滴定前有气泡,滴定后无气泡,则读出的VH2C2O4偏大,所测甲醛浓度偏低,故b错误;c、高锰酸钾溶液中加少量的水,高锰酸钾物质的量不发生变化,因此所测甲醛浓度不变,故c错误;d、装草酸的滴定管未润洗,造成草酸的物质的量浓度偏小,即消耗的草酸的体积增大,即所测甲醛浓度偏低,故d错误;(4)①加入10mLNaOH溶液,溶质为NaHC2O4,物料守恒c(Na+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),电荷守恒:c(Na+)+c(H+)=c(HC2O42-)+2c(C2O42-)+c(OH-),得到质子守恒:c(H+)+ c(H2C2O4)= c(OH-)+ c(C2O42-);②加入NaOH溶液体积为20mL,溶质为Na2C2O4,草酸钠溶液中存在平衡:C2O42-+H2O ![]() HC2O4-+OH-,HC2O4-+H2O
HC2O4-+OH-,HC2O4-+H2O ![]() H2C2O4+OH-,H2O
H2C2O4+OH-,H2O ![]() H++OH-,盐类水解程度是微弱的,因此离子浓度大小顺序是c( Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)。
H++OH-,盐类水解程度是微弱的,因此离子浓度大小顺序是c( Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图是实验室常用的气体制备、净化和收集装置。若依据反应H2C2O4 CO↑+CO2↑+H2O制取CO,则合理的装置组合为( )
CO↑+CO2↑+H2O制取CO,则合理的装置组合为( )

A. ①⑤⑧B. ③⑤⑦C. ②⑤⑥D. ③④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素 X、Y、Z、W,其中 X、Z、W 与氢元 素可组成 XH3、H2Z 和 HW 共价化合物;Y 与氧元素可组成 Y2O 和 Y2O2 离子化合物。
(1)写出 Y2O2 的电子式:______________,其中含有的化学键是______________。
(2)Z 元素在周期表中的位置是______________。X 和 Z 形成的一种二元化合物具有温室效应,其相 对分子质量在 170~190 之间,且 Z 的质量分数约为 70%。该化合物的化学式为______________ 。
(3)XH3、H2Z 和 HW 三种化合物,其中一种与另外两种都能反应的是_________________ (填化学式)。
(4)由 X、W 组成的化合物分子中,X、W 原子的最外层均达到 8 电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,向
时,向![]() 溶液中滴加等浓度的
溶液中滴加等浓度的![]() 溶液,溶液的
溶液,溶液的![]() 与
与![]() 溶液的体积关系如图所示。下列叙述正确的是( )
溶液的体积关系如图所示。下列叙述正确的是( )

A. ![]() 溶液中水的电离程度比
溶液中水的电离程度比![]() 溶液中大
溶液中大
B. ![]() 点溶液中含有
点溶液中含有![]() 和
和![]()
C. ![]() 点,
点,![]()
D. ![]() 点,
点,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)等质量的![]() 和
和![]() ,物质的量之比为______,在相同条件下的体积之比为_______,原子数之比为________.
,物质的量之比为______,在相同条件下的体积之比为_______,原子数之比为________.
(2)同温同压下,相同体积的![]() 和
和![]() 的质量比为_________。
的质量比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素(用字母x等表示)化合价与原子序数的关系图。

根据判断出的元素回答问题:
(1)h在周期表中的位置是__________。
(2)比较z、f、g、r常见离子的半径大小(用化学式表示,下同):______>______>______>______;比较r、m的最高价氧化物对应水化物的酸性强弱:______>______>;比较d、m的氢化物的沸点:______>______。
(3)x与氢元素能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)______,实验室制取该物质的化学方程式为:____________________________________。
(4)由y、m和氢元素组成一种离子化合物,写出其电子式:___________________________。
(5)用铅蓄电池作电源,惰性电极电解饱和em溶液,则电解反应的生成物为(写化学式)___________________________。铅蓄电池放电时正极反应式为式)___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:
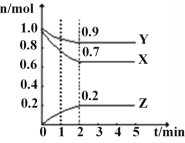
(1)从开始至2min,X的平均反应速率为__。
(2)该反应的化学方程式为___。
(3)1min时,v(正)__v(逆),2min时,v(正)__v(逆)。(填“>”或“<”或“=”)。
(4)上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(X)=9mol·L-1·min-1,乙中v(Y)=0.5mol·L-1·s-1,则___中反应更快。
(5)若X、Y、Z均为气体,在2min时,向容器中通入氩气(容器体积不变),X的化学反应速率将___,若加入适合的催化剂,Y的化学反应速率将___。(填“变大”或“不变”或“变小”)。
(6)若X、Y、Z均为气体(容器体积不变),下列能说明反应已达平衡的是___。
a.X、Y、Z三种气体的浓度相等
b.气体混合物物质的量不再改变
c.反应已经停止
d.反应速率v(X)︰v(Y)=3︰1
e.(单位时间内消耗X的物质的量):(单位时间内消耗Z的物质的量)=3︰2
f.混合气体的密度不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F 是六种短周期元素,它们的原子序数依次增大;A 元素的原子是半径最小的原子;B 元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐 X;D 与 A 同主族,且与 F 同周期;F 元素的最外层电子数是其次外层电子数的 3/4 倍,A、B、D、F 这四种元素,每一种与 C 元素都能形成元素的原子个数比不相同的若干种化合物.D、E、F 三种元素对应的最高价氧化物的水化物间两两皆能反应.请回答下列问题:
(1)写出 C 元素的名称 C_____
(2)写出 C、D 两种元素形成的原子个数比为 1:1 的物质的电子式为_____.
(3)可以验证 C 和 F 两种元素非金属性强弱的结论是(填编号)_____;
①比较这两种元素常见单质的熔点
②比较这两种元素的单质与氢气化合的难易程度
③比较这两种元素的气态氢化物的还原性
(4)A、C、D、F 四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为_____、_____,这两种酸式盐相互反应的离子方程式为_____.
(5)A、C、F 间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为_____.
(6)向含有a mol E 的氯化物的溶液中加入含b mol D 的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为_____.
①a mol ②b mol ③ a/3mol ④ b/3mol ⑤0 ⑥(4a b)mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com