
【题目】下列说法正确的是( )
A. 蔗糖溶液不能导电,蔗糖溶液是非电解质
B. 盐酸能导电的原因是溶液在通电作用下产生了自由移动的离子
C. 酒精在水溶液中和熔融状态下都不导电,酒精是非电解质
D. 氯化钠和硫酸都是电解质,所以它们熔融状态下都能导电
 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如下转化,其中A是单质。
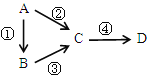
(1)若C是淡黄色固体常用于呼吸面具中的供氧剂,D是一种强碱。则C作供氧剂时与CO2反应的化学方程式为_______________________;其中还原剂是________,氧化产物是___________,7.8g C参加反应时转移的电子数是___________。
(2)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此写出A元素的原子结构示意图是______。请写出A用于焊接铁轨的化学方程式___________________________。请写出②的离子方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种放射性核素,可治疗多种皮肤病。下列有关该核素说法正确的是
是一种放射性核素,可治疗多种皮肤病。下列有关该核素说法正确的是
A. ![]() 的摩尔质量是32
的摩尔质量是32
B. ![]() 和
和![]() 互称为同位素
互称为同位素
C. 1mol ![]() 含质子数约为32×6.02×1023
含质子数约为32×6.02×1023
D. 由质量数可以判断其在周期表的位置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是主要的温室气体,也是一种工业原料。将其固定及利用,有利于缓解温室效应带来的环境问题。
(1)用二氧化碳合成甲醇。
已知:2H2(g)+O2(g)=2H2O(g) △H1=-484 kJ/mol
2CH3OH(g) +3O2(g)=2CO2(g)+4H2O(g) △H2=-1348 kJ/mol
在催化剂作用下,CO2(g)和H2(g)反应生成CH3OH(g)和H2O(g),该反应的热化学方程式是________。
(2)用二氧化碳合成低密度聚乙烯(LDPE)。以纳米二氧化钛膜为工作电极,常温常压电解CO2,可制得LDPE,该电极反应可能的机理如下图所示。

① 过程Ⅰ~Ⅲ中碳元素均发生________反应(填“氧化”或“还原”)。
② CO2转化为LDPE的电极反应式是(补充完整并配平)________
2n CO2 + □________ +□________= ![]() + □________。
+ □________。
③工业上生产1.4×104 kg 的LDPE,理论上需要标准状况下CO2的体积是______L。
(3)用二氧化碳与环氧丙烷(![]() )反应合成可降解塑料PPC,同时也能生成副产物CPC,其化学反应过程中的能量变化如下图所示;在不同温度和压强下,PPC的选择性(产物中PPC的质量与产物总质量的比值)和总产率(产物总质量与反应物投料总质量的比值)如下表所示。
)反应合成可降解塑料PPC,同时也能生成副产物CPC,其化学反应过程中的能量变化如下图所示;在不同温度和压强下,PPC的选择性(产物中PPC的质量与产物总质量的比值)和总产率(产物总质量与反应物投料总质量的比值)如下表所示。

①通过表中数据ⅰ、ⅱ、ⅲ可以得出的结论是________;在25℃时,实际生产中选择反应压强为1.5MPa,而不是2.0MPa,理由是________。
②通过表中数据ⅱ、ⅳ、ⅴ可知温度升高会使PPC的选择性下降,结合上图说明其原因可能是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.日常生活中炒过菜的铁锅未及时洗净,不久会因腐蚀而出现红褐色锈斑。请回答:
①铁锅的锈蚀主要是形成了_____________填(“原电池”或“电解池”),发生__________腐蚀(填“析氢”或“吸氧”)。
②写出铁锅腐蚀时正极的电极反应式: _______________________________
II.①某同学用碳棒、铜棒和稀硫酸、导线等为原材料,实现了通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请在框图空白处画出能够实现这一反应的电化学装置图,并在图中进行必要的标注。_______________________
②某同学在做一定条件下铜与稀硫酸的反应实验时,看到碳棒上有气泡产生,而铜棒却没有被腐蚀。请你分析其原因:_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某些金属离子形成相应氢氧化物时的相关PH值见下表:
难溶物质 | Cu(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
0.1mol/L的金属离子 开始沉淀时PH值 | 4.8 | 1.9 | 3.4 | 9.1 |
完全沉淀(C≦10-5)时PH值 | 6.7 | 3.2 | 4.7 | 11.2 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到较纯的CuCl2·2H2O晶体,可加入______________,调节溶液PH 值至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀。过滤后,将所得滤液经过(填简要实验操作) __________、_________,可得CuCl2·2H2O晶体。
(2)若在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,其原因是______________________________________(用化学方程式表示)。则由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是__________________________。(填写简要的实验步骤或操作)
(3)某学习小组用一定浓度的NaOH溶液作为上述某些金属离子分离时的PH控制试剂,为此需准确滴定其浓度,现用已知浓度0.200 mol/L的标准盐酸进行滴定。请回答:
①取0.200 mol/L的标准盐酸来滴定时,以下操作引起NaOH浓度偏小的是______
A.开始滴定时滴定管尖嘴处留有气泡,滴定后气泡消失
B.指示剂变色即停止滴定,溶液又很快(半分钟内)恢复原色
C.滴定开始时仰视读数,滴定终点时俯视,其余操作正常
D.取用碱液前锥形瓶用蒸馏水洗涤后未风干,其余操作正常
②小组中有同学用另一方法计算出了所用NaOH溶液浓度:取100.00 ml 待测NaOH溶液,向内加入0.200 mol/L的标准盐酸50.00 ml,充分反应后,向所得溶液中加入足量铁粉,收集到标准状况下的气体67.2 ml,则该同学所测得原NaOH溶液在常温下的PH值为____________ (结果保留1位小数,已知lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠的叙述正确的是( )
①钠在空气中燃烧生成氧化钠 ②金属钠可以保存在煤油中
③钠与硫酸铜溶液反应,可以置换出铜 ④金属钠有强还原性
⑤钠原子的最外层上只有一个电子,所以在化合物中钠的化合价显+1价
A.①②④B.②③⑤C.①④⑤D.②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com