
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是
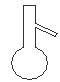
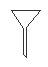
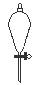
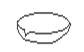
A.蒸馏、蒸发、分液、过滤 B.蒸馏、过滤、分液、蒸发
C.分液、过滤、蒸馏、蒸发 D.过滤、蒸发、分液、蒸馏
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
V、W、X、Y、Z是由周期表中1~20号部分元素组成的5种化合物,其中V、W、X、Z均为两种元素组成。上述5种化合物涉及的所有元素的原子序数之和等于35。它们之间的反应关系如下图:
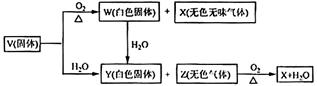
(1)5种化合物分别是V 、W 、X 、Y 、Z :(填化学式)
、Z :(填化学式)
(2)由上述5种化合物中某2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 :
(3)V的电子式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W为原子序数依次增大的四种短周期主族元素,前三种元素原子的电子层数相同,Y、W元素原子的最外电子层上电子数目相同,表中给出了它们的部分信息,请根据这些信息判断下列说法中正确的是
| 元素 | X | Y | Z | W |
| 原子半径(nm) | 0.152 | R1 | R2 | 0.11 |
A.R1>R2>0.11
B.0.152<R1<R2
C.0.152>R1>R2
D.电子层数越多,原子半径越大
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关元素性质的说法不正确的是
A.具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是①
B.具有下列价电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,第一电离能最大的是③
C.①Na、K、Rb ②O、S、Se ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③
D.某元素气态基态原子的逐级电离能分别为738、1 451、7 733、10 540、13 630、17 995、21 703,当它与氯气反应时可能生成的阳离子是X3+
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。

(1)比较两实验装置,图2所示装置的优点是:
①能更好地吸收有毒气体SO2,防止其污染环境;
②___________________________________________。
(2)能说明有SO2气体产生的实验现象是_________________________________________________。
(3)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空白:
A.稀盐酸溶液 B.稀硫酸溶液
C.KSCN溶液 D.KMnO4溶液
E.NaOH溶液 F.淀粉KI溶液
G.H2O2溶液
验证Ⅱ:取试样,先滴加少量的________(填试剂序号,下同),振荡,再滴加少量的________,根据溶液颜色的变化可确定假设Ⅱ是否正确。
验证Ⅲ:步骤1.取试样,滴加少量的________(填试剂序号),溶液的颜色变________色则试样中含有Fe3+,发生反应的离子方程式为_______________________________。
步骤2.再取适量的试样滴加到少量的________(填试剂序号),溶液的颜色变为________色,则试样中含有Fe2+。
查看答案和解析>>
科目:高中化学 来源: 题型:
由下列实验事实得出结论不正确的是( )
A.蔗糖加入浓硫酸后变黑,说明浓硫酸具有脱水性
B.浓硫酸可用作气体干燥剂,说明浓硫酸具有吸水性
C.铜与浓硫酸共热有刺激性气味气体放出,说明浓硫酸具有强氧化性
D.SO2能使紫红色的酸性高锰酸钾溶液褪色,说明SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案正确且能达到相应实验预期目的的是
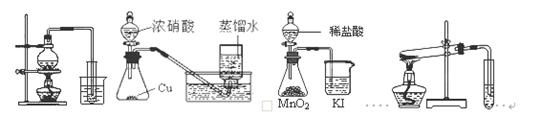
A.制取少量 B. 制取少量NO2 C.比较MnO2、Cl2、 D.探究NH4HCO3
蒸馏水 I2的氧化性 的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
两种气态烃组成的混合气体共0.1mol,完全燃烧后得到标准状况下的3.584L二氧化碳和3.6g的水,下列说法不正确的是 ( )
A一定有甲烷 B不一定有乙烯 C 一定无乙烷 D 一定有乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为
N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。
一种工业合成氨的简式流程图如下:
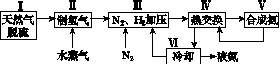
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:________________________________________________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)
ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g)
ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
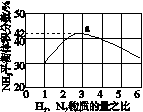

(a) (b)
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com