
A装置中装有淡黄色的固体,分液漏斗中装有浓盐酸,B中盛浓硫酸,C中放有催化剂,D中盛淀粉碘化钾溶液,E中盛足量的NaOH溶液,F中盛FeSO4和H2SO4混合溶液。 
先打开止水夹,通入N2,待装置中空气被赶尽后关诩止水夹,点燃酒精灯:从分液漏斗放入浓盐酸,D中溶液迅速变蓝,F中溶液由浅绿色变为棕黄色(整个装置乖O3)。
(1)淡黄色固体所含化学键的名称为:________;装有遮黄色的固体仪器的名称_______。
(2)如何检查装置的气密性___________________________________________________。
(3)C中反应的化学方程式___________________________________________________。
(4)E装置中反应的离子方程式_______________________________________________。
(5)如F中仍有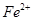 ,如何检验含有Fe2+____________________________________。
,如何检验含有Fe2+____________________________________。
(1)离子键、共价键(2分) 圆底烧瓶(1分)
(2)关闭止水夹,将F中的导管深入水槽中,用酒精灯给圆底烧瓶微热,导管口有气泡产生,冷却后,导管出现水柱。(3分)
(3)4HCl + O2 2Cl2 + 2H2O (2分)
2Cl2 + 2H2O (2分)
(4)Cl2 +2OH? = Cl? + ClO? + H2O (2分)
(5)取F中少量溶液于小试管中,滴加一滴KMnO4溶液,KMnO4溶液褪色,说明含有Fe2+(2分)
解析试题分析:(1)淡黄色固体为Na2O2,含有离子键和共价键。
(2)利用加热气体膨胀的原理进行检验,首先要答上:关闭止水夹,将F中的导管深入水槽中。
(3)C中进入的气体含有HCl、O2,在催化剂存在的条件下加热发生氧化还原反应。
(4)E中发生Cl2与NaOH的反应 。
(5)利用Fe2+具有还原性,能使KMnO4褪色的现象检验。
考点:本题考查化学键、基本仪器、基本实验操作、离子的检验、化学方程式和离子方程式的书写。


科目:高中化学 来源: 题型:实验题
生铁中除铁外,还含有其他元素,如碳元素和硫元素。其中碳主要以碳化铁的形态存在,它使生铁性能坚硬而脆,所以生铁的用途不大,一般用做炼钢的原料。某兴趣小组设计按下图所示的实验装置,测定生铁中的含碳量。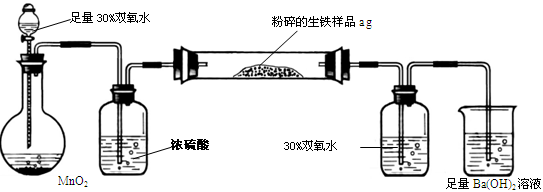
A B C D E
请回答下列问题:
(1)硫在生铁中是有害元素,它使生铁产生热脆性。硫元素在生铁中最有可能存在的价态是
| A.-2 | B.0 | C.+4 | D.+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为测定硫酸亚铁铵晶体【(NH4)2Fe (SO4)2 · xH2O】中铁的含量,某实验小组做了如下实验:
步骤一:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.010mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4-被还原成Mn2+。
再重复步骤二两次。
请回答下列问题:
(1)配制硫酸亚铁铵溶液的操作步骤依次是:称量、 、转移、洗涤并转移、 、摇匀。
(2)用 滴定管盛放KMnO4溶液。
(3)当滴入最后一滴KMnO4溶液,出现 ,即到达滴定终点。反应的离子方程式:
(4)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.04 |
| 2 | 25.00 | 1.50 | 24.50 |
| 3 | 25.00 | 0.20 | 20.21 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学进行实验研究时,欲配1.0mol?L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在足量的水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
(1)烧杯中未溶物可能仅为BaCO3,理由是___________________________________。
(2)假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计实验方案,进行成分检验。在答题纸上进一步完成实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸。 | |
| 步骤3:取适量步骤1中的沉淀于试管中,_____。 | |
| 步骤4: | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O是一种浅绿色晶体,在水中的溶解度较小,不溶于乙醇。某实验小组利用镀锌铁片来制备硫酸亚铁铵的过程如下:
(1)加入盐酸是为了除去锌镀层,判断锌镀层已被除去的现象是 。
(2)A物质可以是 (选填序号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
加入少量A物质的目的是 。
(3)操作Ⅱ的名称为 。
(4)采用晾干而不用加热烘干晶体的原因是 。
(5)工业上常用K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72—被还原成Cr3+。
写出硫酸亚铁铵溶液与酸性K2Cr2O7溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(1)玻璃棒是中学化学实验中常用的仪器。下列实验过程中,一般不需要用玻璃棒的是________(填写编号)。
①用pH试纸测定Na2CO3溶液的pH
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)用“大于”、“小于”或“等于”填空:
①读取量筒中液体的体积时,视线偏高,读取的体积数________实际体积数。
②用托盘天平称取10.4 g食盐,将砝码和食盐的位置颠倒,所称取食盐的质量_____10.4 g。
③配制500 mL 0.1 mol/L NaOH溶液,定容时俯视刻度线,所得溶液的物质的量浓度 _______0.1 mol/L。
④用中和滴定法测某NaOH溶液的浓度,量取待测液时未用该溶液润洗滴定管,测得的溶液浓度________实际浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列每组中各有两对物质,它们都能用分液漏斗分离的是
| A.溴苯和水,酒精和水 | B.四氯化碳和水,溴苯和己烷 |
| C.豆油和水,苯和溴苯 | D.汽油和水,己烷和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列操作能达到实验目的的是 ( )
| | 目 的 | 操 作 |
| A | 确定某卤代烃为氯代烃 | 取某卤代烃少许与NaOH溶液共热后再加盐酸酸化,然后加AgNO3溶液,有白色沉淀 |
| B | 配制银氨溶液 | 在硝酸银溶液中滴加氨水至沉淀恰好消失 |
| C | 提取碘水中的碘 | 将碘水倒入分液漏斗,加入适量乙醇,振荡后静置 |
| D | 确定蔗糖是否发生水解 | 取2 mL水解液滴加少量新制的Cu(OH)2悬浊液,加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验方案合理的是
| A.向苯酚悬浊液中加入少量溴水制取三溴苯酚白色沉淀 |
| B.用高锰酸钾溶液除去乙烯中混有的少量SO2 |
| C.用水鉴别三种无色液体:苯、乙醇、四氯化碳 |
| D.用蒸发的方法分离乙醇(沸点78.5℃)和乙醚(沸点34.5℃) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com