
在恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g) C(g)+D(g),所得实验数据如下表:
C(g)+D(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(A) | n(B) | n(D) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
请回答下列问题
(1)表中 2(选填“>”、“=”或“<”)
2(选填“>”、“=”或“<”)
(2) 800℃时,若起始时向该容器中充入0.5molA(g)、1.0molB(g)、0.3molC(g)、1.8molD(g),则反应开始时的反应速率 v (正) v (逆) (选填“>”、“=”或“<”)。
(3)实验③中,达到平衡时X的转化率为多少?(写出解题过程)
(1)>(2分)(2)<(2分)
(3)【解析】
∵800℃时,反应A(g)+B(g) C(g)+D(g)的平衡常数
C(g)+D(g)的平衡常数
设容器的体积为VL
∴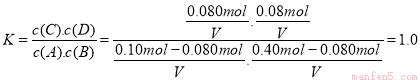 (2分)
(2分)
实验③中,设达平衡时发生转化的A物质的量为x
A(g)+B(g) C(g)+D(g)
C(g)+D(g)
起始浓度
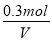 00
00
转化浓度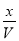



平衡浓度



 (2分)
(2分)
解得x=0.12mol
X的转化率为: (2分)
(2分)
答:实验③中,达平衡时X的转化率为60%
【解析】
试题分析:(1)实验①和实验②若温度相同则生成D的物质的量应该相等,现在温度升高,D的物质的量减少,说明平衡逆向移动,正反应为放热反应,实验④若在800℃下达到平衡时D的物质的量应该为a/2,但若在900℃,则认为平衡逆向移动,有a/2>b,所以a/b>2。(2)根据实验③计算800℃的平衡常数为1,计算起始时的Qc=(0.3×1.8)/(0.5×1)=1.08>1说明反应向逆向进行,正反应速率<逆反应速率。(3)首先计算800℃时化学平衡常数为1,实验③中,设达平衡时发生转化的A物质的量为x
A(g)+B(g) C(g)+D(g)
C(g)+D(g)
起始浓度
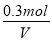 00
00
转化浓度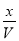



平衡浓度



 (2分)
(2分)
解得x=0.12mol
X的转化率为: (2分)
(2分)
考点:等效平衡,化学平衡常数的应用,转化率计算。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015浙江省高一上学期期末联考化学试卷(解析版) 题型:选择题
现有两瓶溶液,新制饱和氯水和亚硫酸溶液,下列方法或试剂(必要时可加热): ① 观察颜色 ② 石蕊试液 ③ 品红溶液,其中能用于鉴别它们的是
A.①②③ B.只有①③ C.只有②③ D.只有①②
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省高二上学期期末考试化学试卷(解析版) 题型:填空题
(6分)现有浓度为0.1 mol·L-1的五种电解质溶液①Na2CO3;②NaHCO3;③NaAlO2;④CH3COONa; ⑤NaOH,已知:CO2+3H2O+2AlO2- = 2Al(OH)3↓+CO32 -
(1)这五种溶液的pH由小到大的顺序是: (填编号);
(2)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是: (填编号);
(3)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省高二上学期期末考试化学试卷(解析版) 题型:选择题
控制适合的条件,将反应2Fe3++ 2I- = 2Fe2++ I2设计成如下图所示的原电池。下列判断不正确的是

A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省高二上学期期末考试化学试卷(解析版) 题型:选择题
已知:C (s)+ O2(g)=CO(g) H= -110. 50KJ/mol
C (s)+O2(g)=CO2(g) H= -393.51KJ/mol
则反应C (s)+CO2(g)= 2 CO(g)的H为
A、-283.01KJ/mol B、+172.51 KJ/mol
C、+283.01KJ/mol D、-504.01 KJ/mol
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省攀枝花市高二上学期期末考试化学试卷(解析版) 题型:填空题
(10分)按要求回答下列问题:
(1)已知:
1 mol分子中的化学键断时需要吸收能量/kJ | H2(g) | Cl2(g) | HCl(g) |
436 | 243 | 431 |
则:H2(g) + Cl2(g)  2HCl(g) ΔH= kJ/mol
2HCl(g) ΔH= kJ/mol
(2)已知:乙醇的燃烧热为1411.0 kJ/mol,则乙醇燃烧的热化学方程式可表示为 。
(3)在200℃、101kPa时,H2与碘蒸气作用生成2molHI气体,放出14.9 kJ的热量。
热化学方程式可表示为 。
(4)已知:① 2CH3OH(l)+3O2(g)  2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ/mol
2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ/mol
② 2CO(g)+O2(g) 2CO2(g) ΔH2=-566.0 kJ/mol
2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) H2O(l) ΔH3=-44.0 kJ/mol
H2O(l) ΔH3=-44.0 kJ/mol
上述三个反应中,ΔS<0的是 。甲醇燃烧生成一氧化碳和液态水的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省攀枝花市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列各热化学方程式中,化学反应的△H>0的是
A. C(s) + O2(g)  CO2(g) △H1
CO2(g) △H1
B. 4Fe(s) + 3O2(g)  2Fe2O3(s) △H2
2Fe2O3(s) △H2
C. H2O(l) H2O (g) △H3
H2O (g) △H3
D. NaOH (aq) +HCl (aq) NaCl (aq) + H2O(l) △H4
NaCl (aq) + H2O(l) △H4
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省乐山市高一年级上学期期末考试化学试卷(解析版) 题型:填空题
(10分)
某小组同学要配制100 mL 0.100 mol·L-1 Na2CO3溶液。下图是一些关键步骤和操作。

(1)配制过程的先后顺序为(用字母A~F填写) 。
(2)配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、 。
(3)若用Na2CO3·10H2O晶体来配制溶液,但晶体已经部分失去结晶水,则所配得溶液的浓度会 (填“偏高”、“偏低”、“不变”)。
(4)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将 (填“偏高”、“偏低”、“不变”);步骤F称为 ,如果俯视刻度线,配得溶液的浓度将 (填“偏高”、“偏低”、“不变”)。
(5)在步骤B之后,需 才进行下一步操作。
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:填空题
(16分)Na2CO3俗称纯碱、苏打,NaHCO3俗称小苏打,两者在日常生活和工业生产中都有着广泛的应用。某化学兴趣小组设计了如下实验来探究两者的某些性质。请你根据所学知识帮他们完成有关的设计和实验。
(1)甲同学测定两者的酸碱性:各取一定量的固体溶于水,配成相同浓度的溶液,测定其pH值,测定结果为Na2CO3、NaHCO3的pH分别为a和b(a、b均大于7),则a b(填“大于”“等于”或“小于”),测定溶液的pH值所用的主要仪器有:pH试纸、表面皿、 和标准比色卡。
(2)有关①100mL0.1 mol·L-1NaHCO3、 ②100mL0.1 mol·L-1Na2CO3,两种溶液的叙述不正确是
A. NaHCO3溶液中:c (H+)+c (Na+)= c (HCO3-)+2c(CO32-)+c(OH-)
B. Na2CO3溶液中:2c (Na+)= c (HCO3-)+c(CO32-)+ c(H2CO3)
C. ①溶液中:c(CO32-)>c(H2CO3)
D. ②溶液中:c(HCO3-)>c(H2CO3)
(3)乙同学取一定量的碳酸钠溶液于试管中,滴加2~3滴酚酞试液,发现溶液变红,继续滴加BaCl2溶液,预计可观察到 ,请你结合必要的离子方程式,应用平衡的观点解释有关现象的产生: 。
(4)丙同学往10mL0.10 mol·L-1的Na2CO3溶液中逐滴滴加0.10 mol·L-1的HCl,当溶液中的:
c(Na+)=c(Cl-)+c(HCO3-)+2c(CO32-),此时溶液呈 (填“酸性”、“中性”或“碱性”),所用HCl的体积 10mL。(填“大于”“等于”或“小于”)
(5)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.40 mol·L-1的Na2CO3溶液和0.20 mol·L-1的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为 mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com