
| A. | CH2=CH-CH=CH2;l,3 一二丁烯 | |
| B. | CH3CH(C2H5)CH2CH2CH3,2 一乙基戊烷 | |
| C. |  2 一甲基一3一戊烯 2 一甲基一3一戊烯 | |
| D. |  异戊烷 异戊烷 |
分析 A.为丁二烯,不是二丁烯;
B.烷烃的命名中出现2-乙基,说明选取的主链不是最长碳链;
C.编号方向错误,应该从距离碳碳双键最近的一端开始,碳碳双键在2号C;
D.该有机物与戊烷互为同分异构体,为异戊烷.
解答 解:A.CH2=CH-CH=CH2分子中,在1、3号C含有两个碳碳双键,其名称为:l,3 一丁二烯,故A错误;
B.CH3CH(C2H5)CH2CH2CH3的最长碳链含有6个C,主链为己烷,在名称为:3-甲基己烷,故B错误;
C. 的碳碳双键在2号C,甲基在4号C,正确名称为:4-甲基-2-戊烯,故C错误;
的碳碳双键在2号C,甲基在4号C,正确名称为:4-甲基-2-戊烯,故C错误;
D.戊烷分为正戊烷、异戊烷和新戊烷, 为异戊烷的结构简式,故D正确;
为异戊烷的结构简式,故D正确;
故选D.
点评 本题考查了有机物的命名,题目难度不大,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 30g/mol | B. | 60 g/mol | C. | 90g/mol | D. | 120 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
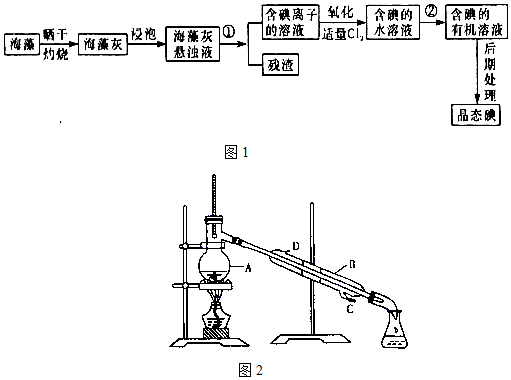
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的名称是2,5,5-三甲基-3-乙基-庚烷
的名称是2,5,5-三甲基-3-乙基-庚烷 .
. .
.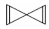 D.
D. 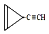 ,其中A、B是链状分子(不考虑这些结构能否稳定存在),请写出所有碳原子均共线的一种链状分子的结构简式:CH≡C-C≡C-CH3.
,其中A、B是链状分子(不考虑这些结构能否稳定存在),请写出所有碳原子均共线的一种链状分子的结构简式:CH≡C-C≡C-CH3.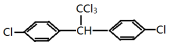 分子中最多有23个原子共面.
分子中最多有23个原子共面.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
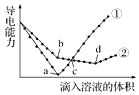 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | c点,两溶液中含有相同量的OH- | |
| B. | b点,溶液中大量存在的离子是Na+、OH- | |
| C. | ①代表滴加H2SO4溶液的变化曲线 | |
| D. | a、d两点对应的溶液均显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中Al3+、NH4+、Cl-、S2- | B. | 酸性溶液中Na+、ClO-、SO42-、I- | ||
| C. | 强碱性溶液中Na+、K+、Cl-、CO32- | D. | 中性溶液中Fe3+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com