
实验室需要0.1mol/L氢氧化钠溶液100mL,现有2mol/L氢氧化钠溶液.
(1)计算所需2mol/L氢氧化钠溶液的体积;
(2)完全中和50mL已配制溶液,需要1mol/L的盐酸多少体积?
| 物质的量浓度的相关计算.. | |
| 专题: | 物质的量浓度和溶解度专题. |
| 分析: | (1)根据稀释定律,稀释前后溶质氢氧化钠的物质的量不变,据此计算需要2mol/L氢氧化钠溶液的体积; (2)根据n=cV计算氢氧化钠的物质的量,再根据HCl+NaOH=NaCl+H2O计算HCl的物质的量,根据V=计算盐酸的体积. |
| 解答: | 解:(1)令需要要2mol/L氢氧化钠溶液的体积为V,根据稀释定律,稀释前后溶质氢氧化钠的物质的量不变,则: 2mol/L×V=0.1mol/L×100mL,解得V=5mL, 答:所需2mol/L氢氧化钠溶液的体积为5mL; (2)50mL0.1mol/L氢氧化钠溶液中氢氧化钠的物质的量为:0.05L×0.1mol/L=0.005mol,根据HCl+NaOH=NaCl+H2O可知参加反应HCl的物质的量为0.005mol,故需要1mol/L的盐酸体积为 答:需要1mol/L的盐酸体积为5mL. |
| 点评: | 本题考查物质的量浓度的有关计算,比较基础,注意公式的灵活运用. |


科目:高中化学 来源: 题型:
有一包粉末可能含有K+、Fe3+、Al3+、Cl-、SO42-、CO32-中的若干种,现进行以下实验:
(1)取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
(2)向(1)溶液中加入一定量Ba(OH)2溶液,生成有色沉淀,过滤后在滤液中加入稀硝酸酸化,然后滴入AgNO3溶液,有白色沉淀生成;
(3)取(2)中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
(4)重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
(5)向(4)的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤。往得到的沉淀中加入过量的NaOH溶液,沉淀减少。
根据上述实验,这包粉末中一定不含有的离子是 ,肯定含有的离子是 ,不能确定是否含有的离子可通过
(填试验方法)来进一步确定该离子。
步骤(5)中发生反应的离子方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:
葡萄酒常用Na2S2O5作抗氧化剂。中华人民共和国国家标准(G112760-2011)规定葡萄酒中抗氧化剂的残留量(以游离SO2计算)不能超过0.25g/L。某兴趣小组用下图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
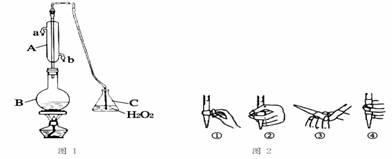
(1)仪器A的名称是 。水通入A的进口为 (填字母)。
(2)B中加人300. 00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应.其化学方程式为 。
(3)除去C中过量的H2O2,然后用0.0900 mol/L NaOH标准溶液进行滴定,滴定前排气泡时,应选择上述图2中的 (填序号);若滴定终点时溶液的pH=8.8,则选择的指示剂为 ;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处时,管内液体的体积 (填序号)(①= 10mL;②=40mL; ③<10mL;④>40mL)
(4)配制100 mL 0. 0900 mol/LNaOH标准溶液的操作如下:
①烧杯中的溶液冷却到室温后,小心转入仪器X中
②将用托盘天平称量好的NaOH固体放入小烧杯中,加适量蒸馏水溶解
③继续加蒸馏水至液面离刻度线1~2 c m处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低点与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都小心转入仪器X中,并轻轻摇匀
⑤将仪器X塞紧,充分摇匀。
上述操作步骤的正确顺序为 (填序号)。仪器X的名称是 。
(5)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为 g/L。
(6)该测定结果比实际值偏高.可能的原因是 ,利用现有装置提出改进的措施为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
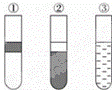
如图,在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )
|
| A. | ①加入的是CCl4,②加入苯,③加酒精 | B. | ①加入的是酒精,②加入CCl4,③加苯 |
|
| C. | ①加入的是苯,②加入CCl4,③加酒精 | D. | ①加入的是苯,②加酒精,③加CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中物质的量浓度为1mol/L的是( )
|
| A. | 将40 g NaOH溶解于1 L水中 |
|
| B. | 将22.4 L HCl气体溶解于水配成1 L溶液 |
|
| C. | 将1 L 5 mol/L的盐酸加水稀释至5L |
|
| D. | 将10 g NaOH配制成 250 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是
A.金属钠和水的反应:Na+2H2O=Na++ OH一+H2↑
B.向次氯酸钙溶液中通入SO2:
Ca2++2ClO-+H2O+SO2=CaSO3+2HClO
C.过量的铁与浓硝酸反应:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O
D.过量的NaHSO4溶液与Ba(OH)2溶液反应:
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂方法完全正确的一组是
A.除去CO中少量的O2,将气体反复通过灼热的Cu网后收集气体
B.除去CuCl2溶液中的少量FeCl3:加入足量铜粉,充分反应后,过滤
C.除去CO2中的少量SO2:通过酸性高锰酸钾溶液洗气
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
硫有多种化合物
(1)硫化氢具有还原性,可以和许多氧化剂反应。H2S通入硫酸酸化的KMnO4溶液,反应生成S、MnSO4等,写出该反应的化学方程式: 。
(2) 将黑色的Fe2S3固体加入足量的盐酸中,溶液中有淡黄色固体生成,产物还有 , 。
(3)硫铁矿是工业生产硫酸的主要原料,硫铁矿氧化焙烧的化学反应如下:
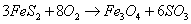
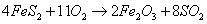
若48mol FeS2完全反应耗用氧气2934.4L(标准状况);反应产物中Fe3O4与Fe2O3物质的量之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com