
【题目】常温下,CH3COOH和NH3·H2O的电离常数均为1.8×10-5。向20 mL浓度均为0.1 mol/L NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的导电率与加入CH3COOH溶液的体积(V)的关系如图所示。下列说法不正确的是

A. a=20,b=40,且溶液呈中性处于A、B两点之间
B. B点溶液中:c(CH3COO-)>c(Na+)>c(NH![]() )
)
C. 已知lg3≈0.5,则C点的pH≈5
D. A、B、C三点中,B点溶液中水的电离程度最大
【答案】A
【解析】由题可知,向20 mL浓度均为0.1 mol/L NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,CH3COOH先和NaOH反应生成CH3COONa,过程中离子浓度降低,导电率降低,故A点时,NaOH被完全反应完,导电率最低,然后,CH3COOH和NH3·H2O反应生成CH3COONH4,使离子浓度增大,导电率增大,故B点时,NH3·H2O反应完全,B点以后,再加入CH3COOH溶液,溶液体积增大,离子浓度下降,导电率下降。A、a=20,b=40,A点时溶质为:CH3COONa、NH3·H2O,B点时,溶质为:CH3COONa 、CH3COONH4,均为碱性,故且溶液呈中性不在A、B两点之间,故A错误;B、B点时,溶液为等浓度的CH3COONa 、CH3COONH4混合溶液,故离子浓度大小为:c(CH3COO-)>c(Na+)>c(NH![]() ),故B正确;C、C点时,溶液是等浓度的CH3COONa、CH3COONH4、CH3COOH溶液,C、c(H+)=
),故B正确;C、C点时,溶液是等浓度的CH3COONa、CH3COONH4、CH3COOH溶液,C、c(H+)=![]() c(CH3COO-)/c(CH3COOH)
c(CH3COO-)/c(CH3COOH)![]() 2,c(H+)
2,c(H+)![]() 故pH≈5,故C正确;D、AB两点均是水解促进水的电离,且B点促进程度更大,故B点溶液中水的电离程度最大,故D正确;故选A。
故pH≈5,故C正确;D、AB两点均是水解促进水的电离,且B点促进程度更大,故B点溶液中水的电离程度最大,故D正确;故选A。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.写出下列反应电极方程式
(1)(﹣)Zn|ZnSO4溶液||CuSO4|Cu(+),负极反应:________
(2)(﹣)Pb|H2SO4(浓)|PbO2(+) 正极反应:______________
(3)(﹣)H2(Pt)|KOH溶液|(Pt)O2(+) 负极反应:_____________
Ⅱ.某化学兴趣小组用下图所示装置进行电化学原理的实验探究,试回答下列问题:
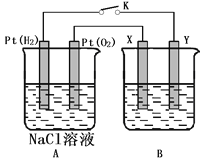
(1)通O2的Pt电极为电池_____________极(填电极名称),其电极方程式为_____________。
(2)若B电池为精炼铜,且粗铜中含有Zn、Fe、Ag、Au等杂质,则该电池阳极泥的主要成分是_______。
(3)若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态链烃能使溴水褪色,经测定该烃存在支链,并且0.1mol该烃充分燃烧可以生成7.2g水,请据此回答下列问题.
(1)通过计算确定该烃具有的分子式和结构简式.
(2)请对(1)中所确定的烃进行系统命名.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组称取纯净的Na2SO3 ·7H20 a克,隔绝空气加强热至恒重,经过分析与计算,得到的固体质量与全部转化为亚硫酸钠固体的计算值一致,但固体在水中溶解后测的pH值比理论计算值(相同浓度Na2SO3溶液的pH)大很多。下列说法不正确的是
A. 连续两次称量强热前后固体的质量,如质量差小于0.1g,即可判断固体已经恒重
B. 产生上述矛盾的可能解释:4Na2SO3 ![]() 3Na2SO4 + Na2S
3Na2SO4 + Na2S
C. 固体产物中加入稀盐酸可能有淡黄色沉淀产生
D. 加入BaCl2溶液,出现白色沉淀,则能确定产物中有Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有科学家预青,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。
(1)已知破坏1moIH-H键、1molO=O键、1molH -O键时分别需要吸收436kJ、498kJ、465kJ的能量,下图表示H2、O2转化为H2O的反应过程中的能量变化,则b=_______。
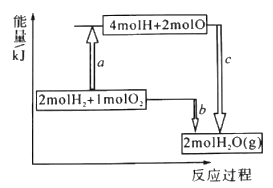
(2)在l0lkPa下,lg氢气完全燃烧生成液态水放出142. 9kJ的热量,该反应的热化学方程式为_______。
(3)为探究实验室制氢气反应的热效应,选择下图装置进行实验。

①若x为水,y为生石灰,则实验过程中U形管中可观察到的现象是___________。
②若x为稀盐酸,y为锌粒,观察到与①相同的实验现象,则说明锌与稀盐酸制氢气的反应是_________(填“放热反应”或“吸热反应”)。
(4)已知:
H2SO4 (aq) +2KOH (aq)=K2SO4 (aq)+2H2O(1) △H =Q1kJ/mol
H2SO4(浓)+2NaOH(aq) =Na2SO4 (aq) +2H2O(1) △H =Q2 kJ/mol
HNO3 (aq)+KOH(aq)=KNO3 (aq)+H2O(l) △H =Q3 kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3值的大小关系为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+ , 其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( ) 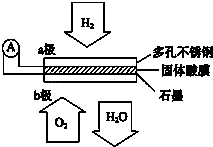
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e﹣=4OH﹣
C.每转移0.1 mol电子,消耗标准状况下1.12 L的H2
D.OH﹣由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俄罗斯用“质子﹣M”号运载火箭成功将“光线”号卫星送入预定轨道。发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
(1)H2(g)=H2(l)△H1=﹣0.92kJmol﹣1
(2)O2(g)=O2(l)△H2=﹣6.84kJmol﹣1
(3)如图:下列说法正确的是( )
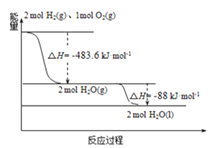
A. 2mol H2(g)与1mol O2(g)所具有的总能量比2molH2O(g)所具有的总能量低
B. 氢气的燃烧热为△H=﹣241.8 kJmol﹣1
C. 火箭液氢燃烧的热化学方程式2H2(l)+O2(l)═2H2O(g)△H=﹣474.92kJmol﹣1
D. H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.1mol/LBaCl2溶液中含有的钡离子数为NA
B.1mol镁原子中含有的电子数为2NA
C.常温常压下,11.2LH2O中含有的分子数为0.5NA
D.16gO3和O2的混合物中含有的氧原子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com