
ЁОЬтФПЁПФГЛЏбЇаЫШЄаЁзщГЦШЁДПОЛЕФNa2SO3 ЁЄ7H20 aПЫЃЌИєОјПеЦјМгЧПШШжСКужиЃЌОЙ§ЗжЮігыМЦЫуЃЌЕУЕНЕФЙЬЬхжЪСПгыШЋВПзЊЛЏЮЊбЧСђЫсФЦЙЬЬхЕФМЦЫужЕвЛжТЃЌЕЋЙЬЬхдкЫЎжаШмНтКѓВтЕФpHжЕБШРэТлМЦЫужЕЃЈЯрЭЌХЈЖШNa2SO3ШмвКЕФpHЃЉДѓКмЖрЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A. СЌајСНДЮГЦСПЧПШШЧАКѓЙЬЬхЕФжЪСПЃЌШчжЪСПВюаЁгк0.1gЃЌМДПЩХаЖЯЙЬЬхвбОКужи
B. ВњЩњЩЯЪіУЌЖмЕФПЩФмНтЪЭЃК4Na2SO3 ![]() 3Na2SO4 ЃЋ Na2S
3Na2SO4 ЃЋ Na2S
C. ЙЬЬхВњЮяжаМгШыЯЁбЮЫсПЩФмгаЕЛЦЩЋГСЕэВњЩњ
D. МгШыBaCl2ШмвКЃЌГіЯжАзЩЋГСЕэЃЌдђФмШЗЖЈВњЮяжагаNa2SO4
ЁОД№АИЁПD
ЁОНтЮіЁПAЁЂСЌајСНДЮГЦСПЧПШШЧАКѓЙЬЬхЕФжЪСПЃЌШчжЪСПВюаЁгк0.1gЃЌМДПЩХаЖЯЙЬЬхвбОКужиЃЌЙЪAе§ШЗЃЛBЁЂгЩгкNa2SO3МШОпгабѕЛЏадгжОпгаЛЙдадЃЌNa2SO3МгШШКѓЗЂЩњСЫЦчЛЏЗДгІЃЌСђдЊЫиЛЏКЯМлДг+4МлБфЛЏЮЊ-2МлКЭ+6МлЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃК4Na2SO3=Na2S+3Na2SO4ЃЌЙЪBе§ШЗЃЛCЁЂЙЬЬхжаПЩФмЛЙгаNa2SO3ЃЌNa2SO3гыNa2SдкЫсадЬѕМўЯТПЩвдЙщжаЗДгІЩњГЩСђЕЅжЪЃЌЫљвдЙЬЬхВњЮяжаМгШыЯЁбЮЫсПЩФмгаЕЛЦЩЋГСЕэВњЩњЃЌЙЪCе§ШЗЃЛDЁЂЙЬЬхжаПЩФмЛЙгаNa2SO3ЃЌМгШыBaCl2ШмвКЃЌГіЯжАзЩЋГСЕэЃЌдђВЛФмШЗЖЈВњЮяжагаNa2SO4ЃЌЙЪDДэЮѓЃЛЙЪбЁDЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПХфжЦ0.2mol/LNa2SO4ШмвК50mLЃЌашвЊГЦШЁЙЬЬхNa2SO4ЕФжЪСПЪЧЖрЩй?
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИєОјПеЦјМгШШжС500ЁцЪБТЬЗЏЃЈСђЫсбЧЬњОЇЬхЃЉФмЭъШЋЗжНтЃЌФГЛЏбЇаЁзщЮЊЬНОПЗжНтВњЮяЕФГЩЗжЃЌбЁгУЯТЭМЫљЪОзАжУНјааЪЕбщЃЈМаГжзАжУТдЃЉЃЌAжаЙЬЬхЭъШЋЗжНтКѓБфЮЊКьзиЩЋЗлФЉЁЃ

ЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A. ЫљбЁгУзАжУЕФе§ШЗСЌНгЫГађЮЊA-C-E-D-B
B. EзАжУЪЧгУРДМьбщSO3ЃЌдђXПЩвдЪЧЯѕЫсЫсЛЏЕФЯѕЫсБЕШмвК
C. ПЩбЁгУЫсадKMnO4ШмвКМьбщAзАжУжаВаСєЙЬЬхЪЧЗёЮЊFe2O3
D. ИУЗДгІЕФЛЏбЇЗНГЬЪНПЩФмЪЧ2FeSO4ЁЄ7H2O=Fe2O3+SO2Ёќ+SO3Ёќ+14H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙигкШчЭМЫљЪОЂйЁЂЂкСНИізАжУЕФа№ЪіЃЌе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ 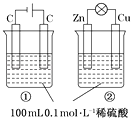
A.зАжУУћГЦЃКЂйЪЧдЕчГиЃЌЂкЪЧЕчНтГи
B.СђЫсХЈЖШБфЛЏЃКЂйдіДѓЃЌЂкМѕаЁ
C.ЕчМЋЗДгІЪНЃКЂйжабєМЋЃК4OHЉЉ4eЉ=2H2O+O2ЁќЂкжае§МЋЃКZnЉ2eЉ=Zn2+
D.РызгвЦЖЏЗНЯђЃКЂйжаH+ЯђвѕМЋЗНЯђвЦЖЏ ЂкжаH+ЯђИКМЋЗНЯђвЦЖЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЭМЪОЕФЫЕЗЈе§ШЗЕФЪЧ

A. ЭММзБэЪОCH4 (g)+2O2 (g)=CO2 (g)+2H2O(1)ЕФФмСПБфЛЏ
B. ЭМввБэЪОбЙЧПЖд2A(g)+2B(g)![]() 3C(g)+D(g)ЕФгАЯьЃЌЧвбЙЧПЃКPМз>Pвв
3C(g)+D(g)ЕФгАЯьЃЌЧвбЙЧПЃКPМз>Pвв
C. ЭМБћБэЪОЮТЖШЖдN2 (g)+3H2(g)![]() NH3 (g) ЁїH<0ЕФгАЯь
NH3 (g) ЁїH<0ЕФгАЯь
D. ЭМЖЁБэЪОN2 (g)+3H2(g)![]() 2NH3 (g)ЦНКтЪБNH3ЬхЛ§ЗжЪ§ЫцЦ№ЪМn(N2)ЃЏn(H2)ЕФБфЛЏЃЌдђзЊЛЏТЪЃКІСA(H2)=ІСB(H2)
2NH3 (g)ЦНКтЪБNH3ЬхЛ§ЗжЪ§ЫцЦ№ЪМn(N2)ЃЏn(H2)ЕФБфЛЏЃЌдђзЊЛЏТЪЃКІСA(H2)=ІСB(H2)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌCH3COOHКЭNH3ЁЄH2OЕФЕчРыГЃЪ§ОљЮЊ1.8ЁС10Ѓ5ЁЃЯђ20 mLХЈЖШОљЮЊ0.1 mol/L NaOHКЭNH3ЁЄH2OЕФЛьКЯвКжаЕЮМгЕШЮяжЪЕФСПХЈЖШЕФCH3COOHШмвКЃЌЫљЕУЛьКЯвКЕФЕМЕчТЪгыМгШыCH3COOHШмвКЕФЬхЛ§ЃЈVЃЉЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

A. a=20ЃЌb=40ЃЌЧвШмвКГЪжаадДІгкAЁЂBСНЕужЎМф
B. BЕуШмвКжаЃКc(CH3COOЃ)ЃОc(NaЃЋ)ЃОc(NH![]() ЃЉ
ЃЉ
C. вбжЊlg3Ёж0.5ЃЌдђCЕуЕФpHЁж5
D. AЁЂBЁЂCШ§ЕужаЃЌBЕуШмвКжаЫЎЕФЕчРыГЬЖШзюДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкКуШнУмБеШнЦїжаКЯГЩМзДМЃЛCO(g)+2H2(g)![]() CH3OH(g)ЁЃ
CH3OH(g)ЁЃ
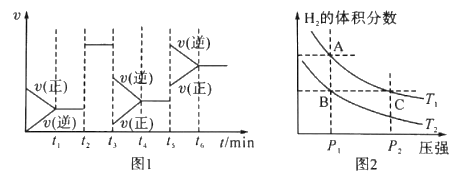
(1)ЭМ1жаt3ЪБПЬИФБфЕФЬѕМўЪЧ____ЃЌt5ЪБПЬИФБфЕФЬѕМўЪЧ____.
(2)ХаЖЯЗДгІДяЕНЛЏбЇЦНКтзДЬЌЕФвРОнЪЧ____ЃЈЬюађКХЃЉЁЃ
aЃЎЩњГЩCH3OHЕФЫйТЪгыЯћКФCOЕФЫйТЪЯрЕШ
bЃЎЛьКЯЦјЬхЕФУмЖШВЛБф
cЃЎЛьКЯЦјЬхЕФзмЮяжЪЕФСПВЛБф
dЃЎCH3OHЁЂCOЁЂH2ЕФХЈЖШЖМВЛдйЗЂЩњБфЛЏ
(3)ШчЭМ2БэЪОдкЮТЖШЗжБ№ЮЊT1ЁЂT2ЪБЃЌЦНКтЬхЯЕжаH2ЕФЬхЛ§ЗжЪ§ЫцбЙЧПБфЛЏЧњЯпЃЌAЁЂBСНЕуЕФЗДгІЫйТЪЃКA____B(ЬюЁА>ЁБЁАЃЛЁБЛђЁА<ЁБЃЌЯТЭЌ)ЃЌAЁЂCСНЕуЕФЛЏбЇЦНКтГЃЪ§ЃКA____CЁЃ
(4)КуШнЬѕМўЯТЃЌЯТСаДыЪЉжаФмЪЙ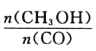 діДѓЕФга_____ЁЃ
діДѓЕФга_____ЁЃ
A.Щ§ИпЮТЖШ BЃЎГфШыHeЦј CЃЎЪЙгУДпЛЏМС DЃЎдйГфШы1molCOКЭ2moIH2
(5)дкФГЮТЖШЯТЃЌШнЛ§ОљЮЊ2LЕФШ§ИіУмБеШнЦїжа-АДВЛЭЌЗНЪНЭЖШыЗДгІЮяЁЃГѕЪМЭЖСЯгыИїШнЦїДяЕНЦНКтЪБЕФгаЙиЪ§ОнШчЯТЃК

ЯТСаЫЕЗЈе§ШЗЕФЪЧ____ЃЈЬюзжФИЃЉЁЃ
AЃЎдкИУЮТЖШЯТЃЌМзШнЦїжаДгЗДгІПЊЪМЕНЦНКтЫљашЪБМфЮЊ4minЃЌдђv(H2)ЮЊ0.25 mol/(LЁЄmin)
BЃЎзЊЛЏТЪЃКІС3 >ІС1ЃЌЦНКтЪБn(CH3OH)ЃКn3>1.0mol
CЃЎБћШнЦїжаЃЌЦНКтКѓНЋШнЦїЕФШнЛ§бЙЫѕЕНдРДЕФ1ЃЏ2ЃЌЦНКтГЃЪ§KдіДѓ
DЃЎЬхЯЕЕФбЙЧПЃКp3<2p1=2P2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏбЇгУгяЪЧбЇКУЛЏбЇжЊЪЖЕФживЊЛљДЁЃЌЯТСагаЙиЛЏбЇгУгяБэЪОе§ШЗЕФгаЃЈ ЃЉ
ЂйгУЕчзгЪНБэЪОHClЕФаЮГЩЙ§ГЬЃК![]()
ЂкMgCl2ЕФЕчзгЪНЃК![]() ЂлжЪСПЪ§ЮЊ133ЁЂжазгЪ§ЮЊ78ЕФяЄдзгЃК
ЂлжЪСПЪ§ЮЊ133ЁЂжазгЪ§ЮЊ78ЕФяЄдзгЃК![]() Cs
Cs
ЂмввЯЉЁЂввДМНсЙЙМђЪНвРДЮЮЊЃКCH2=CH2ЁЂC2H6O ЂнS2ЉЕФНсЙЙЪОвтЭМЃК![]()
ЂоДЮТШЫсЗжзгЕФНсЙЙЪНЃКH-O-Cl ЂпCO2ЕФЗжзгФЃаЭЪОвтЭМ:![]()
A. 3Иі B. 4Иі C. 5Иі D. 6Иі
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУвЛжжЪдМСГ§ШЅЯТСаЮяжЪжаЕФдгжЪЃЌаДГіЫљМгЕФЪдМСМАгаЙиЗДгІЕФРызгЗНГЬЪНЃЎ
Na2CO3ШмвКЃЈNaHCO3ЃЉЃКЪдМС ЃЌ РызгЗНГЬЪН ЃЎ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com