
【题目】化学用语是学好化学知识的重要基础,下列有关化学用语表示正确的有( )
①用电子式表示HCl的形成过程:![]()
②MgCl2的电子式:![]() ③质量数为133、中子数为78的铯原子:
③质量数为133、中子数为78的铯原子:![]() Cs
Cs
④乙烯、乙醇结构简式依次为:CH2=CH2、C2H6O ⑤S2﹣的结构示意图:![]()
⑥次氯酸分子的结构式:H-O-Cl ⑦CO2的分子模型示意图:![]()
A. 3个 B. 4个 C. 5个 D. 6个
【答案】A
【解析】①用电子式表示化合物的形成过程时,左边为原子的电子式;②氯化镁中含有两个氯离子不能合并;③元素符号的左上角写质量数,左下角写质子数,根据质量数=质子数+中子数分析;④乙烯的结构简式为CH2=CH2,乙醇的结构简式为C2H5OH;⑤硫离子核电荷数为16,电子数18;⑥次氯酸中氧原子分别和氢原子、氯原子形成共价键;⑦碳原子半径大于氧原子半径。
①用电子式表示化合物的形成过程时,左边为原子的电子式,故①错误;
②氯化镁中含有两个氯离子,应写成![]() ,故②错误;
,故②错误;
③元素符号的左上角写质量数,左下角写质子数,根据质量数=质子数+中子数分析,质子数=133-78=55,故③正确;
④乙烯的结构简式为CH2=CH2,乙醇的结构简式为C2H5OH,故④错误;
⑤硫离子核电荷数为16,电子数为18,故⑤正确;
⑥次氯酸中氧原子分别和氢原子、氯原子形成共价键,故⑥正确。
⑦碳原子半径大于氧原子半径,故⑦错误。
综合以上分析,正确的有③⑤⑥三项,故答案选A。


科目:高中化学 来源: 题型:
【题目】常温下,Ka(CH3COOH)=1.8×10-5,分别向20mL0.1mol/LNaHCO3溶液和CH3COOH溶液中逐滴加入0.1mol/LNaOH溶液,滴定曲线如图所示,下列叙述正确的是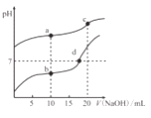
A. a点溶液中存在:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
B. b、d点溶液中离子浓度的大小关系均为c(Na+)3COO-)
C. C点溶液中存在:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)
D. d点溶液中: n(CH3COO-)/n(CH3COOH)=180
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组称取纯净的Na2SO3 ·7H20 a克,隔绝空气加强热至恒重,经过分析与计算,得到的固体质量与全部转化为亚硫酸钠固体的计算值一致,但固体在水中溶解后测的pH值比理论计算值(相同浓度Na2SO3溶液的pH)大很多。下列说法不正确的是
A. 连续两次称量强热前后固体的质量,如质量差小于0.1g,即可判断固体已经恒重
B. 产生上述矛盾的可能解释:4Na2SO3 ![]() 3Na2SO4 + Na2S
3Na2SO4 + Na2S
C. 固体产物中加入稀盐酸可能有淡黄色沉淀产生
D. 加入BaCl2溶液,出现白色沉淀,则能确定产物中有Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+ , 其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( ) 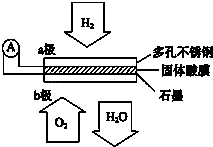
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e﹣=4OH﹣
C.每转移0.1 mol电子,消耗标准状况下1.12 L的H2
D.OH﹣由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在蒸馏实验中,下列叙述不正确的是( )
A.用锥形瓶来接收冷凝出的液体B.将温度计水银球插入蒸馏烧瓶中的液面下
C.冷水从冷凝管下口进入,上口流出D.加入沸石的作用是防止液体暴沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俄罗斯用“质子﹣M”号运载火箭成功将“光线”号卫星送入预定轨道。发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
(1)H2(g)=H2(l)△H1=﹣0.92kJmol﹣1
(2)O2(g)=O2(l)△H2=﹣6.84kJmol﹣1
(3)如图:下列说法正确的是( )
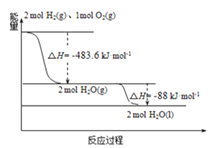
A. 2mol H2(g)与1mol O2(g)所具有的总能量比2molH2O(g)所具有的总能量低
B. 氢气的燃烧热为△H=﹣241.8 kJmol﹣1
C. 火箭液氢燃烧的热化学方程式2H2(l)+O2(l)═2H2O(g)△H=﹣474.92kJmol﹣1
D. H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( )
A.燕馏B.过滤C.升华D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
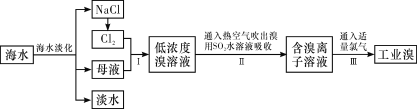
(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是__________。
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是______________。写出步骤Ⅱ中发生反应的离子方程式:________________________________。
(3)制备钠单质的方法之一是将熔融NaCl进行电解,写出电解化学方程式:__________________。
(4)已知某溶液中Cl-、Br-、I-的物质的量之比为2∶3∶4,现欲使溶液中的Cl-、Br-、I-的物质的量之比变成4∶3∶2,那么要通入Cl2的物质的量是原溶液中I-的物质的量的_____。(填选项)
A.![]() B.
B.![]() C.
C.![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气用于工业合成氨 N2(g)+3H2(g)2NH3(g);△H=﹣92.2kJmol﹣1 . 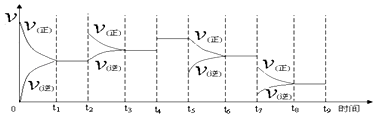
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,正逆反应速率与时间的关系如图所示,其中t4﹑t5﹑t7时刻对应的实验条件改变分别是
t4 .
t5 .
t7 .
②温度为T℃时,将2nmolH2和nmolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%,此时放出热量46.1kJ.则n= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com