
【题目】下列说法错误的是( )
A. 从1L1mol/L的氯化钠溶液中取出10mL,其浓度仍是1mol/L
B. 制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况)
C. 0.5 L2mol/L的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023
D. 10g 98% 硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的浓度是不同的
【答案】D
【解析】A. 溶液是均一稳定的,则从1L 1mol/L的氯化钠溶液中取出10mL后,其浓度仍是1mol/L,A正确;B. 制成0.5L 10mol/L的盐酸,需要氯化氢气体的物质的量是0.5L×10mol/L=5mol,在标准状况下的体积是5mol×22.4L/mol=112L,B正确;C. 0.5 L2mol/L的氯化钡溶液中,氯化钡的物质的量是0.5L×2mol/L=1mol,则钡离子和氯离子的物质的量分别是1mol、2mol,因此离子总数为3×6.02×1023,C正确;D. 根据![]() 可知10g 98%硫酸(密度为1.84g/cm3)的浓度是
可知10g 98%硫酸(密度为1.84g/cm3)的浓度是![]() ,所以与10mL 18.4mol/L硫酸的浓度是相同的,D错误,答案选D。
,所以与10mL 18.4mol/L硫酸的浓度是相同的,D错误,答案选D。


科目:高中化学 来源: 题型:
【题目】化石燃料仍是目前能源的主体,但已经面临危机,开发新能源是解决能源问题的关键。下列能量转换过程,不涉及化学变化的是
A. 利用氢氧燃料电池提供电能 B. 利用太阳能分解水制备氢气
C. 利用水流驱动涡轮机发电 D. 利用植物秸秆为原料生产乙醇燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,
①正反应为放热反应
②反应物总能量低于生成物总能量
③反应物的总键能小于生成物的总键能
④1molA与1molB充分反应后,能量变化为△E
⑤加入催化剂后,反应加快,△E减小
⑥反应达到平衡时,升高温度,A的转化率增大
⑦升高温度可增大正反应速率,降低逆反应速率
⑧E2是反应C(g)+D(g)A(g)+B(g) 的活化能
以上有关说法正确的是( )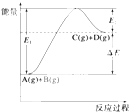
A.⑤⑥⑦⑧
B.①②③④
C.①③⑤⑦
D.②⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与生产生活关系密切。请完成下列填空:
(1)某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。

①装置甲中盛放浓硝酸的仪器A的名称是______, 装置丙中的试管内发生反应的离子方程式为:_______________________。
②为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是____________。
(2)NO在医疗上有重要的应用,曾被科学家作为研究的重要物质。现有容积为aL的试管盛满NO后倒扣于水槽中,再向试管中通入一定体积O2后,试管内气体的体积为试管容积的一半,则通入的O2的在相同条件下体积为_________。
A 0.75aL B 0.375aL C 0.625aL D 1.25aL
(3)实验室常用下图所示装置制取并收集氨气。

①实验室制取氨气反应的化学方程式为____________________________________;
②图中方框内收集氨气的装置可选用_________________(填字母序号);
③尾气处理装置中使用倒扣漏斗的作用是_________________________________。
(4)在盛有一定量浓硝酸的试管中加入6.4g的铜片发生反应。请回答下列问题:
①开始阶段,反应的化学方程式为____________________________________,后一阶段生成气体的颜色为____________,若整个反应过程共产生标准状况下气体2.24L,则反应过程中被还原的HNO3的物质的量为_______。
②反应结束后铜片有剩余,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种常见的无机物,它们分别能与下图中周围4种物质在一定条件下反应:请回答下列问题:
(1)A溶液与B溶液反应的离子方程式 .
(2)若A与其周围某物质在一定条件下反应,产物之一是B周围的一种,则此反应的离子方程式为
(3)请写出B溶液分别与Cl2、Al(OH)3反应的离子方程式:
(4)在A、B周围的8种物质中,有些既能与A反应又能与B反应.则这些物质可能是: . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应无论怎样调整反应物的用量都只能生成一种物质的是( )
A.甲烷和氯气混合后光照发生反应
B.乙烯与氯化氢的加成反应
C.1,3﹣丁二烯与氢气发生反应
D.乙炔和氯气的加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料.
(1)Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 .
(2)Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 ![]() 2CaSO4+2Cl2↑+2H2O
2CaSO4+2Cl2↑+2H2O
他们利用该反应设计如下制取氯气并验证其性质的实验.
回答下列问题:
①该实验中A部分的装置是(填标号).
②请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤): .
③写出D装置中发生反应的离子方程式 .
④该实验存在明显的缺陷,请你提出改进的方法 .
⑤该小组又进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置.待完全反应后,用0.1molL﹣1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为:2Na2S2O3+I2═Na2S4O6+2NaI,共用去Na2S2O3溶液20.0mL.则该漂白粉中Ca(ClO)2的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关浓硫酸的性质或作用,叙述错误的是( )
A.浓硫酸的脱水性是化学性质B.与氯化钠固体共热制氯化氢气体时,表现强酸性
C.干燥SO2时体现吸水性D.使铁、铝钝化表现了强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、H、O、N这4种元素是组成细胞的基本元素,它们占细胞鲜重的百分比正确的是( )
A. C>H>O>NB. O>C>H>N
C. C>O>H>ND. O>H>C>N
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com