
| A.Na+ 、K+、Cl-、 NO3- | B.Cu2+、K+、SO42-、NO3- |
| C.Na+、 K+、SO42-、HCO3- | D.Fe3+、K+、SO42-、Cl- |
科目:高中化学 来源:不详 题型:单选题
| A.氯气溶于水: Cl2+ H2O ===2H+ + Cl—+ ClO— |
B.氯化铝溶液中加入过量氨水:Al3+ + 4NH3·H2O ===AlO2- +4NH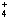 + 2H2O + 2H2O |
C.过量二氧化硫通入氢氧化钠溶液中:SO2 + OH- ===SO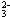 + H2O + H2O |
| D.氢氧化铝与足量盐酸反应,Al(OH)3 + 3H+ ="==" Al3+ + 3H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.0mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| C.pH=12的溶液:K+、Na+、CH3COO-、Br- |
| D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu2+、K+、Cl-、NO3- |
| B.Ag+、Na+、Cl-、NO3- |
| C.Mg2+、Al3+、SO42-、Cl- |
| D.Ba2+、NH4+、 Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.Na+、 、Ca2+、 、Ca2+、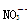 |
B.Na+、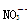 、Al3+、Cl 、Al3+、Cl |
C.K+、 、Cl-、Cu2+ 、Cl-、Cu2+ |
D.Ba2+、Cl-、K+、 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.醋酸和氢氧化钠 | B.盐酸和氢氧化铜 |
| C.硫酸和氢氧化钡 | D.硫酸和氢氧化钾 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 组别 | 一元酸 | NaOH | 混合溶液的pH |
| 甲 | c(HX)="0.1" mol/L | c(NaOH)=0.1mol/L | pH = a |
| 乙 | c(HY)=c1 mol/L | c(NaOH)=0.1mol/L | pH = 7 |
| 丙 | c(HZ)="0.1" mol/L | c(NaOH)=0.1mol/L | pH = 9 |
| 丁 | pH=2 HZ | pH=12 NaOH | pH = b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com