
| ||
| ||
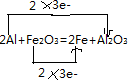 反应中铁元素化合价降低为0价,物质Fe2O3做氧化剂,铁元素被还原;化合价升高的物质Al做还原剂,还原剂HAl被氧化得到氧化产物Al2O3;故答案为:Fe2O3 Al2O3 ;
反应中铁元素化合价降低为0价,物质Fe2O3做氧化剂,铁元素被还原;化合价升高的物质Al做还原剂,还原剂HAl被氧化得到氧化产物Al2O3;故答案为:Fe2O3 Al2O3 ;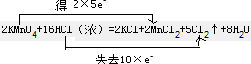 ;依据化合价变化,锰元素化合价从+7价变化为+2价,化合价降低,被还原,HCl中的氯元素化合价从-1价变化为0价,化合价升高被氧化得到氧化产物Cl2;依据化学方程式中的定量关系分析,16molHCl参加反应,其中10mol被氧化,6mol气酸性作用生成盐,所以被氧化的HCl和未被氧化HCl的质量比为10:6=5;3;故答案为:锰 Cl2 5:3;
;依据化合价变化,锰元素化合价从+7价变化为+2价,化合价降低,被还原,HCl中的氯元素化合价从-1价变化为0价,化合价升高被氧化得到氧化产物Cl2;依据化学方程式中的定量关系分析,16molHCl参加反应,其中10mol被氧化,6mol气酸性作用生成盐,所以被氧化的HCl和未被氧化HCl的质量比为10:6=5;3;故答案为:锰 Cl2 5:3;

科目:高中化学 来源: 题型:
| ||




查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Cu+H2O 还原剂______,氧化产物______,______;
Cu+H2O 还原剂______,氧化产物______,______;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Al2O3+2Fe 氧化剂______,氧化产物______,
Al2O3+2Fe 氧化剂______,氧化产物______,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com