
【题目】下列关于CO2和CO的有关说法正确的是
A.标准状况下,等体积的CO2与CO的质量比是7:11
B.标准状况下,等质量的CO2与CO分子数之比是11:7
C.同温同压下,等体积的CO2与CO的密度之比是11:7
D.同温同容下,等质量的CO2与CO的压强之比是11:7
 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,22.4L CCl4含有的分子数目为NA
B.7.8g Na2O2与水完全反应转移的电子数为0.1 NA
C.常温常压下,16 g O2和O3的混合气体中含氧原子2NA
D.常温常压下,1L0.l mol/LNaHSO4溶液中HSO4-数目为 0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4 L SO3含有NA个分子
B.常温常压下 4.4 g乙醛所含σ键数目为0.6 NA
C.密闭容器中2 mol NO与1 mol O2充分反应,产物分子数为2 NA
D.18 g D2O中含有的质子数为10 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L 的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:
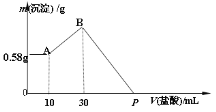
(1)混合物中NaOH的质量是_______g
(2)AlCl3的物质的量是____________ mol
(3)MgCl2的物质的量是___________ mol
(4)P点所表示盐酸加入体积为___________ mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
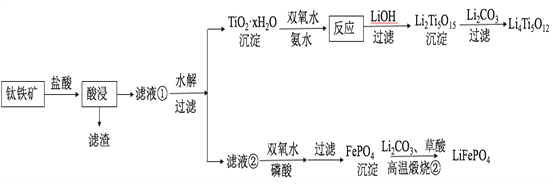
回答下列问题:
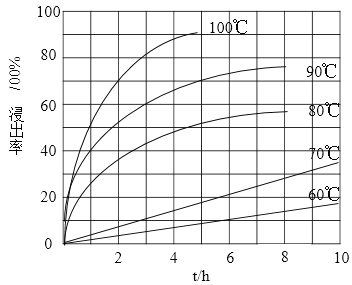
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对乙酰氨基苯酚,俗称扑热息痛,具有很强的解热镇痛作用,工业上通过下列方法合成(B1和B2、C1和C2分别互为同分异构体,无机产物略去):
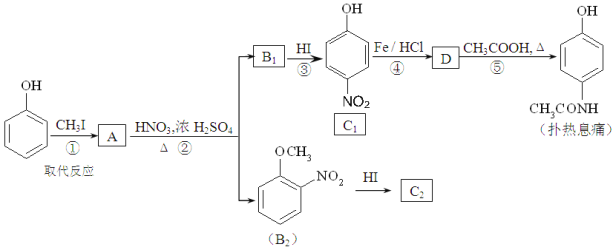
已知:
请回答下列问题:
(1)A的结构简式为 ______________,C2的结构简式为 _________________。
(2)上述②~⑤的反应中,属于取代反应的有________________(填数字序号)。
(3)工业上不是直接用硝酸氧化苯酚得到C1,而是设计反应①、②、③来实现,其目的是________________________________________________。
(4)反应⑤的化学方程式为_____________________________________________。
(5)扑热息痛有多种同分异构体,其中符合下列条件的同分异构体共有______种。
a.苯环上只有两个取代基,其中一个含碳不含氮,另一个含氮不含碳;
b.两个氧原子与同一个原子相连。
其中核磁共振氢谱中只出现四组峰,且峰面积比为3:2:2:2,又不能发生水解反应的同分异构体的结构简式为_____________________________。其中既能发生银镜反应,也能分别与盐酸、氢氧化钠溶液反应,在核磁共振氢谱中只出现五组峰的同分异构体的结构简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】翡翠是玉石中的一种,其主要成分为硅酸铝钠NaAl(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。请回答下列问题:
(1)基态镍原子的外围电子排布图为___________;与其同周期的基态原子的M层电子全充满的元素位于周期表的__________、___________区。
(2)翡翠中主要成分硅酸铝钠中四种元素电负性由小到大的顺序是___________。
(3)铬可以形成CrCl3·x NH3(x=3、4、5、6)等一系列配位数为6的配合物。
①NH3分子的ⅤSEPR模型是___________。
②键角大小关系NH3___________PH3(填“>”<”或“=”)。
③NF3不易与Cr3+形成配离子,其原因是___________。
(4)铁有δ、γ、α三种同素异形体,如下图所示。
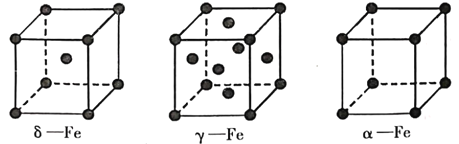
γ-Fe晶体的一个晶胞中所含有的铁原子数为___________,δ-Fe、α-Fe两种晶胞中铁原子的配位数之比为___________。已知δ-Fe晶体的密度为dg/cm,NA表示阿伏伽德罗常数的数值,则Fe原子半径为___________pm(列表达式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com