
【题目】设NA 为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,22.4L CCl4含有的分子数目为NA
B.7.8g Na2O2与水完全反应转移的电子数为0.1 NA
C.常温常压下,16 g O2和O3的混合气体中含氧原子2NA
D.常温常压下,1L0.l mol/LNaHSO4溶液中HSO4-数目为 0.1NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】青金石是碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氧、氧等元素,曾用来制作颜料。
(1)在周期表中,与Si的化学性质最相似的邻族元素是_________。
(2) Na+和 Ne互为等电子体,电离能 I2(Na)_________I1(Ne)填"〉”或“<")。
(3)已知氯、硫有多种含氧酸,HClO4中共价键类型有_____,硫酸的结构式为_____。
(4)氢卤酸(HX)的电离过程如图。△H1和△H2的递变规律:HF > HCl> HBr >HI,其中△H1(HF)特别大的原因为________,影响△H2递变的因素为________。
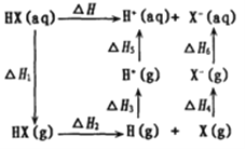
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是()
A.将1 mol/L NaAlO2和1.5 mol/L的HCl等体积互相均匀混合:6AlO+9H++3H2O=5Al(OH)3↓+Al3+
B.NaHCO3溶液中加入过量的Ba(OH)2溶液:2![]() +Ba2++2OH-=BaCO3↓+2H2O
+Ba2++2OH-=BaCO3↓+2H2O
C.Fe(OH)3溶于HI溶液:Fe(OH)3+3H+=Fe3++3H2O
D.在过氧化氢里加入酸性的高锰酸钾:2![]() +3H2O2 + 6H+ =2Mn2+ + 4O2↑+ 6H2O
+3H2O2 + 6H+ =2Mn2+ + 4O2↑+ 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (1)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。完成下列填空:
①As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体. 若As2S3和SnCl2恰好完全反应,As2S3和SnCl2的物质的量之比为_______.该反应的氧化剂是_____,反应产生的气体可用_______吸收.
②As2S3和HNO3有如下反应:__As2S3+__NO3-+_____=__H3AsO4+__S+__NO2↑+_______
A.将方程式补充完整并配平
B.若生成1 mol H3AsO4,则反应中转移电子的物质的量为________.
(2)某温度下将Cl2通入KOH溶液中,反应后得到KCl,KClO和KClO3的混合溶液,经测定ClO-和![]() 的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为___.若5mol Cl2参加反应,转移电子数为______________(用NA表示阿伏伽德罗常数)
的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为___.若5mol Cl2参加反应,转移电子数为______________(用NA表示阿伏伽德罗常数)
(3)某一反应体系中有反应物和生成物共五种物质:S,H2S,HNO3,NO,H2O. 该反应的化学方程式为______________________;若反应过程中转移了0.3mol电子,则氧化产物的质量是______g;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题
(1)“金属钙线”是炼制优质钢材的脱氧脱磷剂,某“金属钙线”的主要成分为金属M和金属钙Ca,并含有3.5%(质量分数)CaO.
①Ca元素原子结构示意图________,Ca(OH)2碱性比Mg(OH)2______(填“强”或“弱”).
②配平用“金属钙线”脱氧脱磷的方程式:___P +____FeO +____CaO![]() ____Ca3(PO4)2 +____Fe
____Ca3(PO4)2 +____Fe
③将“金属钙线”试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色的M(OH)n,该颜色变化过程的化学方程式为:_____________________,实验室检测Mn+最常用的试剂是___________(填化学式)
④取3.2 g“金属钙线”试样,与水充分反应,生成448 mL H2(标准状况),在所得溶液中通入适量的CO2,最多能得到CaCO3________g,“金属钙线”试样中金属M的质量分数为______.
(2)氢化钙(CaH2)固体登山运动员常用的能源提供剂
①写出CaH2与水反应的化学方程式__________________,该反应的氧化产物是___.
②请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象_____.
③登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是_______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的盐酸和醋酸溶液,c(Cl-) = c(CH3COO-)= 0.01 mol/L,下列说法正确的是
A.pH:醋酸>盐酸
B.完全反应消耗NaOH的量:醋酸>盐酸
C.与相同的Na2CO3粉末反应的起始速率:醋酸<盐酸
D.分别用水稀释相同倍数后,所得溶液中:c (Cl-) = c (CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在工业生产生活中有很重要的作用。已知:实验室中可用KClO3与浓盐酸发生如下反应:
(_____)KClO 3+(_____)HCl(浓)-(_____)KCl+(_____)Cl2↑+(____) H2O,
(1)请配平该反应,并用双线桥法标出电子转移的方向和数目。______________
(2)该反应中氧化剂为______;氧化剂与还原剂的物质的量之比为______;氧化产物与还原产物的物质的量之比为______;被氧化的元素和被还原的元素的质量之比为_________。
(3)浓盐酸在反应中表现出来的性质是________________(填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸
(4)当此反应中产生标准状况下13.44L的Cl2 ,则该反应转移的电子的数目为_____;被氧化的盐酸的物质的量为______mol,参加反应的盐酸的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(1)用双线桥表示出电子转移的方向和数目________,题干中反应改写成离子方程式是____。
(2)电解食盐水的过程中,被还原的元素是____________,氧化产物是______。
Ⅱ.四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-=Fe3O4↓+S4O62-+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________。
(2)反应的化学方程式中x=______。
(3)每生成1 mol Fe3O4,反应转移的电子为____mol,被Fe2+还原的O2的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于CO2和CO的有关说法正确的是
A.标准状况下,等体积的CO2与CO的质量比是7:11
B.标准状况下,等质量的CO2与CO分子数之比是11:7
C.同温同压下,等体积的CO2与CO的密度之比是11:7
D.同温同容下,等质量的CO2与CO的压强之比是11:7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com