
【题目】氯及其化合物在工业生产生活中有很重要的作用。已知:实验室中可用KClO3与浓盐酸发生如下反应:
(_____)KClO 3+(_____)HCl(浓)-(_____)KCl+(_____)Cl2↑+(____) H2O,
(1)请配平该反应,并用双线桥法标出电子转移的方向和数目。______________
(2)该反应中氧化剂为______;氧化剂与还原剂的物质的量之比为______;氧化产物与还原产物的物质的量之比为______;被氧化的元素和被还原的元素的质量之比为_________。
(3)浓盐酸在反应中表现出来的性质是________________(填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸
(4)当此反应中产生标准状况下13.44L的Cl2 ,则该反应转移的电子的数目为_____;被氧化的盐酸的物质的量为______mol,参加反应的盐酸的物质的量为______mol。
【答案】1 6 1 3 3 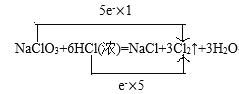 NaClO3 1:5 5:1 5:1 ② NA 1 1.2
NaClO3 1:5 5:1 5:1 ② NA 1 1.2
【解析】
(1)根据电子得失守恒配平该反应方程式为:NaClO3+6HCl(浓)=NaCl+3Cl2↑+3H2O,并用双线桥法标出电子转移的方向和数目: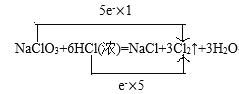 ;
;
(2)该反应中NaClO3氯元素化合价由+5变为0价,化合价降低得电子,做氧化剂,HCl中氯元素化合价由-1价变为0价,化合价升高失电子,做还原剂,由反应NaClO3+6HCl(浓)=NaCl+3Cl2↑+3H2O可知,6mol盐酸中只有5mol被氧化,因此氧化剂与还原剂的物质的量之比为1:5;氧化剂为1mol,则对应的还原产物为1mol,还原剂5mol,则对应的氧化产物为5mol,氧化产物与还原产物的物质的量之比为5:1;被氧化的元素和被还原的元素都是氯元素,质量之比等于氯元素的物质的量之比为5:1;
(3)浓盐酸在反应中一部分化合价不变生成氯化钾,表现酸性,一部分化合价升高被氧化,表现还原性;
(4)标准状况下13.44L的Cl2 为0.6mol,由反应NaClO3+6HCl(浓)=NaCl+3Cl2↑+3H2O,生成3mol氯气转移5mol电子,因此生成0.6mol氯气转移1mol电子,则该反应转移的电子的数目为NA;生成3mol氯气消耗6mol盐酸,其中被氧化的盐酸为5mol,因此生成0.6mol氯气,消耗1.2mol盐酸,其中被氧化的盐酸占参与反应盐酸总量的![]() ;
;
(1)根据电子得失守恒配平该反应方程式为:NaClO3+6HCl(浓)=NaCl+3Cl2↑+3H2O,并用双线桥法标出电子转移的方向和数目: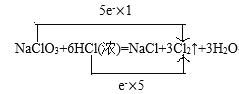 ,
,
答案为:1;6;1;3;3;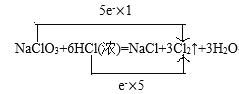 ;
;
(2)该反应中NaClO3氯元素化合价由+5变为0价,化合价降低得电子,做氧化剂,HCl中氯元素化合价由-1价变为0价,化合价升高失电子,做还原剂,由反应NaClO3+6HCl(浓)=NaCl+3Cl2↑+3H2O可知,6mol盐酸中只有5mol被氧化,因此氧化剂与还原剂的物质的量之比为1:5;氧化剂为1mol,则对应的还原产物为1mol,还原剂5mol,则对应的氧化产物为5mol,氧化产物与还原产物的物质的量之比为5:1;被氧化的元素和被还原的元素都是氯元素,质量之比等于氯元素的物质的量之比为5:1,
答案为:NaClO3;1:5;5:1;5:1;
(3)浓盐酸在反应中一部分化合价不变生成氯化钾,表现酸性,一部分化合价升高被氧化,表现还原性,
答案选②;
(4)标准状况下13.44L的Cl2 为0.6mol,由反应NaClO3+6HCl(浓)=NaCl+3Cl2↑+3H2O,生成3mol氯气转移5mol电子,因此生成0.6mol氯气转移1mol电子,则该反应转移的电子的数目为NA;生成3mol氯气消耗6mol盐酸,其中被氧化的盐酸为5mol,因此生成0.6mol氯气,消耗1.2mol盐酸,其中被氧化的盐酸占参与反应盐酸总量的![]() ,其物质的量为1.2mol ×
,其物质的量为1.2mol ×![]() =1mol,
=1mol,
答案为:NA;1;1.2;


科目:高中化学 来源: 题型:
【题目】下列有关物质结构或性质的说法不正确的是( )
A.三联苯![]() 与四联苯
与四联苯![]() 互为同系物
互为同系物
B.可用燃烧法鉴别环乙烷、苯、CCl4
C.分子式为C5H10的烃存在顺反异构体
D.分子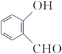 中所有原子可能位于同一平面
中所有原子可能位于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向废水中加入硫化物可以依次获得CuS、 ZnS纳米粒子。常温下,H2S的Ka1=1.3×10-7,Ka2=7.1×10-15,溶液中平衡时相关离子浓度的关系如图,下列说法错误的是
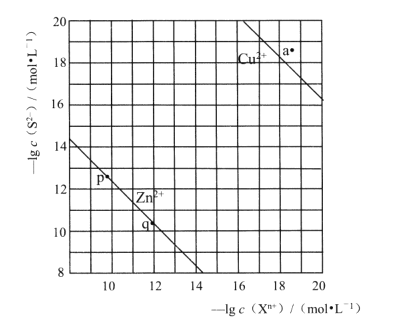
A.Ksp(CuS)的数量级为10-37
B.a点对应的CuS溶液为不饱和溶液
C.向p点的溶液中加入少量NaS固体,溶液组成由p向q方向移动
D.H2S+Zn2+![]() ZnS + 2H+平衡常數很大,反应趋于完全
ZnS + 2H+平衡常數很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,22.4L CCl4含有的分子数目为NA
B.7.8g Na2O2与水完全反应转移的电子数为0.1 NA
C.常温常压下,16 g O2和O3的混合气体中含氧原子2NA
D.常温常压下,1L0.l mol/LNaHSO4溶液中HSO4-数目为 0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为三套实验装置。

(1)写出下列仪器的名称:a.__________,b._____________。
(2)若利用装置1分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,冷凝水由________(填f或g) 口通入。
(3)用装置II分离混合物时,为使液体顺利流下,应进行的操作是_______________。
(4)实验室用Na2CO3·10H2O 晶体配制0.05mol/L 的Na2CO3 溶液970mL。
①应用托盘天平称取Na2CO3·10H2O 的质量是____g。
②装置III是某同学转移溶液的示意图。图中的错误是_______________。
③除了图中给出的仪器和托盘天平以及烧杯外,为完成实验还需要的仪器有:______________。
Ⅱ利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
(1)溶液配制:称取1.200 0 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在________中溶解,完全溶解后,全部转移至100 mL的________中,加蒸馏水至________。
(2)滴定:取0.00950 mol·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:Cr2O72-+6I-+14H+===3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32-===S4O62-+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液______,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为______%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列流程回答:
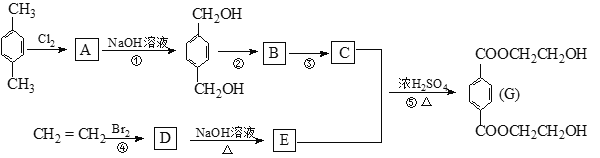
(1) 写出结构简式 C______ E_________。
(2)指出反应类型: ① ___________ ③ _____________ ⑤ ____________
(3)写出化学方程式 C + E ![]() G____________
G____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是
A.H2O+CaO=Ca(OH)2
B.2H2O+2F2=4HF+O2
C.2H2O![]() O2↑+2H2↑
O2↑+2H2↑
D.3NO2+ H2O=2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4 L SO3含有NA个分子
B.常温常压下 4.4 g乙醛所含σ键数目为0.6 NA
C.密闭容器中2 mol NO与1 mol O2充分反应,产物分子数为2 NA
D.18 g D2O中含有的质子数为10 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com