
| A.E可能是一种金属元素 |
| B.在ECln中E与Cl之间形成共价键 |
| C.E位于元素周期表的IVA族 |
| D.E的一种氧化物为EO |
科目:高中化学 来源:不详 题型:填空题
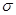 ”或“
”或“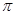 ”)。
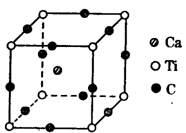
”)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:N>O>F |
| B.酸性强弱:HNO3>H3PO4>H2SO4 |
| C.碱性强弱:KOH >NaOH>Mg(OH)2 |
| D.氢化物的稳定性:HF>HCl>H2S |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
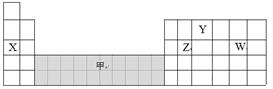
| A.可在灰色区域“甲”中寻找催化剂 |
| B.离子半径:W-﹥Y3-﹥X+ |
| C.气态氢化物的稳定性:Z﹥W |
| D.工业上电解X和W化合物的水溶液制备X |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素原子核外电子层排布呈周期性变化 |
| B.元素相对原子质量依次递增 |
| C.元素原子半径大小呈周期性变化 |
| D.元素的最高正化合价呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.X、Y、Z中最简单氢化物稳定性最弱的是Y |
| B.Z元素氧化物对应水化物的酸性一定强于Y |
| C.X元素形成的单核阴离子还原性强于Y |
| D.Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分别由Y、Z组成的单质一定都为原子晶体 |
| B.W与X形成的两种化合物中阴、阳离子的个数比均为1∶2 |
| C.Y、Z、R最高价氧化物对应水化物的酸性强弱顺序:R>Z>Y |
| D.X的氢化物比R的氢化物稳定,X的氢化物熔沸点比R的氢化物低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 族 周期 | | | | |||||
| 1 | ① | | | | | | | |
| 2 | | | | | | ② | | |
| 3 | ③ | | | ④ | | ⑤ | ⑥ | |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.A原子得到电子的数目比B原子少 |
| B.A元素的最高正价比B元素的最高正价要高 |
| C.气态氢化物溶于水后的酸性:A比B强 |
| D.A单质能与B的氢化物水溶液反应,生成B单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com