
【题目】将一定量Cu投入到100mL18mol·L﹣1的浓硫酸中,加热使之充分反应,在标准状况下收集到4.48L气体(假设气体全部逸出)。请计算:
(1)收集到气体的物质的量为__mol。
(2)若往反应后的溶液中加入NaOH溶液,并使得溶液中的Cu2+完全沉淀,至少需要8mol·L﹣1NaOH_____mL。
【答案】0.2 400
【解析】
Cu只与浓硫酸发生反应:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O, 向反应后的溶液中加入NaOH,发生2NaOH+H2SO4=Na2SO4+2H2O、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,据此分析;
CuSO4+SO2↑+2H2O, 向反应后的溶液中加入NaOH,发生2NaOH+H2SO4=Na2SO4+2H2O、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,据此分析;
Cu只与浓硫酸发生反应:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O, 向反应后的溶液中加入NaOH,发生2NaOH+H2SO4=Na2SO4+2H2O、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,
CuSO4+SO2↑+2H2O, 向反应后的溶液中加入NaOH,发生2NaOH+H2SO4=Na2SO4+2H2O、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,
(1)收集气体的物质的量为n(SO2)=![]() =0.2mol;
=0.2mol;
(2)根据上述分析,当Cu2+完全沉淀,溶液中的溶质为Na2SO4,即消耗NaOH的物质的量n(NaOH)=2n(Na2SO4)=2×(100×10-3L×18mol·L-1-0.2mol)=3.2mol,消耗NaOH的体积为V(NaOH)=![]() =0.4L,合400mL。
=0.4L,合400mL。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】有关下列四组实验描述不正确的是
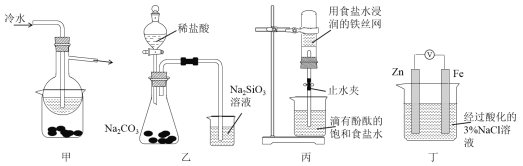
A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl
B. 利用装置乙可证明非金属性强弱:Cl>C>Si
C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池总反应为Fe+2Fe3+=3Fe2+,下列与此电,池总反应不符的原电池是( )
A.铜片、铁片、FeCl3溶液组成的原电池
B.石墨、铁片、Fe(NO3)3溶液组成的原电池
C.铁片锌片、Fe2(SO4)3溶液组成的原电池
D.银片、铁片、Fe(NO3)3溶液组成的原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25C时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n随时间1的变化如图1所示,已知反应达到平衡后,降低温度,A的转化率将增大。

(1)根据图1数据。写出该反应的化学方程式:_____________;此反应的平衡常数表达式为K=_________,从反应开始到第一次平衡时的平均速率v(A)为________。
(2)在5~7min内,若K值不变,则此处曲线变化的原因是_________。
(3)图2表示此反应的反应速率v和时间t的关系,t3、t5、t6时刻各改变一个且互不相同的条件,各阶段的平衡常数如下表所示。K1、K2、K3、K4之间的关系为________(用“>”“<”或“=”连接)。A的转化率最大的一段时间是___________。
t2~t3 | t4~t5 | t5~t6 | t7~t8 |
K1 | K2 | K3 | K4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超导材料为具有零电阻及磁性的物质,以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3Ox。现欲合成0.5 mol此高温超导物,依化学计量数比例需取Y2O3、BaCO3和CuO的物质的量分别为( )
A. 0.50 mol、0.50 mol、0.50 mol B. 0.25 mol、1.0 mol、1.5 mol
C. 0.50 mol、1.0 mol、1.5 mol D. 1.0 mol、0.25 mol、0.17 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代社会环境变化快、生活节奏快,很多人心理压力过大,紧张焦虑,导致抑郁患者量增加。某研究小组按下列路线合成抗抑郁药物吗氯贝胺:
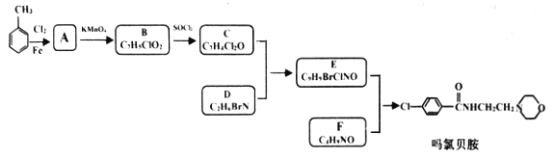
已知: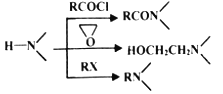
请回答:
(1)下列说法正确的是___________。
A.化合物A分子中有两种氢原子 B.合成路线所涉反应均为取代反应
C.化合物D具有碱性 D.吗氯贝胺能发生水解反应
(2)化合物F的结构简式是______________________。
(3)写出C+D→E的化学方程式____________________________________________。
(4)为探索新的合成路线,发现用化合物C与X(C6H14N2O)一步反应即可合成吗氯贝胺。请设计以环氧乙烷(![]() )为原料合成X的合成路线_________________________________(用流程图表示,无机试剂任选)。
)为原料合成X的合成路线_________________________________(用流程图表示,无机试剂任选)。
(5)符合以下条件的化合物X(C6H14N2O)可能的同分异构体有___________种。其中只有一条侧链的同分异构体的结构简式为______________________(任写一种)。
①分子中有一个六元环,且成环原子中最多含一个非碳原子。
②1H-NMR谱显示分子中有5种氢原子;IR谱表明分子中有N-N键,无O-H键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(含有质量分数为8%的TeO2、少量Ag、Au)为原料制备单质碲的一种工艺流程如下,(已知TeO2微溶于水,易溶于强酸和强碱),下列有关说法不正确的是
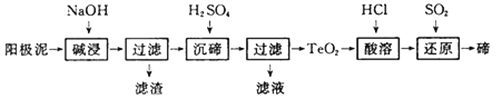
A. 将阳极泥研磨、反应适当加热都有利于提高“碱浸”的速率和效率
B. “碱浸”时发生主要反应的离子方程式为TeO2+2OH-=TeO32-+H2O
C. “沉碲”时为使碲元素沉淀充分,应加入过量的硫酸
D. 若提取过程碲元素的回收率为90%,则处理1kg这种阳极泥最少需通入标准状况下SO2 20.16L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com