
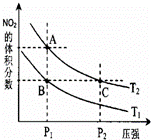
反应N2O4(g)⇌2NO2(g)△H=57kJ•mol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )
|
| A. | a、c两点的反应速率:a>c |
|
| B. | a、c两点气体的颜色:a深,c浅 |
|
| C. | 由状态b到状态a,可以用加热的方法 |
|
| D. | a、c两点气体的平均相对分子质量:a>c |
| 体积百分含量随温度、压强变化曲线.. | |
| 专题: | 化学平衡专题. |
| 分析: | N2O4(g)═2NO2(g)△H=+57kJ•mol﹣1,该反应为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答. A、a、c两点都在等温线上,压强越大,反应速率越快; B、增大压强平衡向逆反应进行,向逆反应进行是减小由于压强增大导致浓度增大趋势,但到达平衡仍比原平衡浓度大; C、压强相同,升高温度,化学平衡正向移动,NO2的体积分数增大,a点NO2的体积分数大; D、增大压强,化学平衡逆向移动,c点时气体的物质的量小,混合气体的总质量不变,据此判断. |
| 解答: | 解:A.由图象可知,a、c两点都在等温线上,c的压强大,则a、c两点的反应速率:a<c,故A错误; B.由图象可知,a、c两点都在等温线上,c的压强大,与a相比c点平衡向逆反应进行,向逆反应进行是由于减小体积增大压强,平衡移动的结果降低NO2浓度增大趋势,但到达平衡仍比原平衡浓度大,平衡时NO2浓度比a的浓度高,NO2为红棕色气体,则a、c两点气体的颜色:a浅,c深,故B错误; C.升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,a点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,故C正确; D.由图象可知,a、c两点都在等温线上,c的压强大,增大压强,化学平衡逆向移动,c点时气体的物质的量小,混合气体的总质量不变,则平均相对分子质量大,即平均相对分子质量:a<c,故D错误; 故选:C. |
| 点评: | 本题考查化学平衡的图象,明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”原则即可解答,难度不大.注意B选项为易错点,改变压强的本质为体积变化. |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
将Mg、Cu组成的混合物26.4g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是 ( )
A.43.2g B. 46.8g C. 53.6g D. 63.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg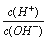 ,室温下实验室用0.01 mol·L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如右图所示。下列有关叙述正确的是( )
,室温下实验室用0.01 mol·L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如右图所示。下列有关叙述正确的是( )

A.A点时加入氢氧化钠溶液体积为20 mL
B.室温时0.01 mol·L-1的醋酸溶液pH=4
C.OA段溶液中:c(CH3COO-)> c(CH3COOH)
D.若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH) = c(OH-) - c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知有机物之间能发下如下反应:
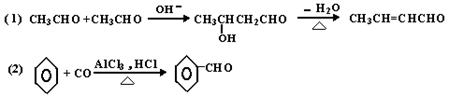
下列有机化合物A~H有如下图所示的转化关系:
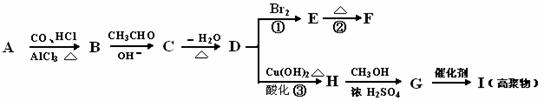
其中,化合物D的分子式为C10H10O,其苯环上的一氯代物只有两种;F的分子式为C10H8O,且所有碳原子在同一平面上。请回答下列问题:
(1)写出下列物质的结构简式:A I
(2)反应①的反应类型为 反应②的条件为 。化合物F中氢原子的种类有 种。
(3)写出下列反应的化学方程式:B→C 。
(4)化合物D有多种同分异构体,满足下列条件的有6种(一个碳原子上不可能两个双键):①属于酚类;②结构中除苯环外无其他环;③苯环上只有两种互为对位的取代基。其中的三种结构简式如下:
请写出其它三种结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
下列生产或实验事实引出的相应结论不正确的是( )
| 选项 | 事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
| B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
| C | 在容积可变的密闭容器中发生反应:2NH3(g)⇌N2H4(l)+H2(g),把容积的体积缩小一半 | 正反应速率加快,逆反应速率减慢 |
| D | A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应N2(g)+3H2(g)⇌2NH3(g)△H<0,下列研究结果和示意图相符的是( )
| A | B | C | D | |
| 研究 结果 | 压强对反应的影响 | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与环境、材料、信息、能关系密切,下列说法正确的是
A.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
B.绿色化学的核心是利用化学原理治理环境污染
C.将煤气化或液化,获得清洁燃料
D.PM2.5是指大气中直径接近于2.5×10-6 m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能。工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H 1= - 90.7 kJ·mol-1
CH3OH(g) △H 1= - 90.7 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g)+H2O(g) △H2 = - 23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2 = - 23.5 kJ·mol-1
③CO(g)+H2O(g)  CO2(g)+H2(g) △H3 = - 41.2 kJ·mol-1
CO2(g)+H2(g) △H3 = - 41.2 kJ·mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)。
CH3OCH3(g)+CO2(g)。
该反应的反应热△H =_________。催化反应室中采用300℃的反应温度,理由是 。
(2)已知:反应①在300℃时的化学平衡常数为0.27。该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 (填“正向进行”、“逆向进行”或“处于平衡状态”)。
(3)上述流程中二甲醚精制的实验操作名称为 。
(4)右图为绿色电“二甲醚燃料电池”的工作原理示意图。
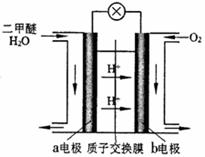
该电池工作时,H+向 极移动(填“正”或“负”);a电极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁4种物质均为含有两种元素的化合物,其分子均含有18个电子,下列说法正确的是
A.若气体甲的水溶液在常温下的pH<7,则甲一定是HCl
B.若气体乙的摩尔质量与O2相同,则乙一定是N2H4
C.若3.0g丙的物质的量为0.1mol,则丙一定是甲烷的同系物
D.若丁为四原子分子,则丁一定能使品红溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com