
将Mg、Cu组成的混合物26.4g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是 ( )
A.43.2g B. 46.8g C. 53.6g D. 63.8g
【知识点】化学与环境C2D4
【答案解析】B 解析:本题涉及反应有:Cu失去2e-生成Cu2+,结合2OH−生成Cu(OH)2,Mg失去2e-生成Mg2+,结合2OH−生成Mg(OH)2,反应后生成Cu(OH)2和Mg(OH)2,可知Mg、Cu在反应中失去电子的物质的量等于生成沉淀需要氢氧根离子的物质的量,根据HNO3 得3e-生成NO,生成8.96LNO转移的电子为 8.96L÷22.4L/mol×3=1.2mol,
所以反应后生成沉淀的质量为26.4g+1.2mol×17g/mol=46.8g.
故答案选B
【思路点拨】本题考查混合物的计算,题目难度中等,本题注意把握电子转移的数目和氢氧根离子之间的关系,为解答该题的关键。


科目:高中化学 来源: 题型:
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

(1)若A是淡黄色固体,B是气态氢化物,C、D是氧化物,C是造成酸雨的主要物质,写出
反应④的化学方程式__________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式: __________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:__________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。D的化学式是______。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。简述检验溶液D中金属阳离子的操作方法及现象:
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W四种元素原子序数依次增大且均小于36。 Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒, W基态原子有10个价电子。回答下列问题(以下问题均以推知元素符号作答):
(1)若 YX3与X2Z﹑YX2-与ZX-﹑Y3-与Z2-性质相似,请写出Mg(YX2)2在一定条件下分解的化学反应方程式
⑵已知0℃时X2Z的密度为a g/cm3,其晶胞中X2Z分子的空间排列方式与金刚石晶胞类似,相似的原因是 。两个X2Z分子间的最近距离为 pm(用a和NA表示)。已知X2Y的升华热是51 kJ/mol,除氢键外,X2Z分子间还存在范德华力(11 kJ/mol),则X2Z晶体中氢键的“键能”是 kJ/mol。
⑶ WZ是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。工业上常以W(YZ3)2·6X2Z和尿素[CO(NH2)2]为原料制备。
①W2+的基态核外电子排布式为 ,其核外电子有 种运动状态。
②尿素分子中碳原子的杂化方式为 ,1 mol尿素分子中含有的σ键数为 。
 ③YZ3-的空间构型 。
③YZ3-的空间构型 。
④WZ晶体的结构与NaCl相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如右图所示的缺陷:一个W2+空缺,另有两个W2+被两个W3+所取代。其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。经测定某样品中W3+与W2+的离子数之比为6∶91。若该晶体的化学式为WxZ,则x= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )
A.野火烧不尽,春风吹又生 B.春蚕到死丝方尽,蜡炬成灰泪始干
C.粉身碎骨浑不怕,要留青白在人间 D.爆竹声中一岁除,春风送暖入屠苏
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组在溶液中反应,不管反应物的量是多少,都能用同一离子方程式表示的是( )
A.FeBr2与Cl2 B.Ba(OH)2与H2SO4
C.HCl与Na2CO3 D.NaHCO3与Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:
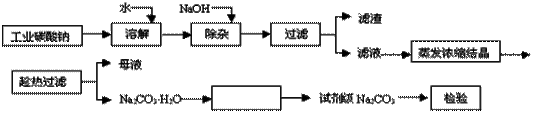
已知碳酸钠的溶解度(S)随温度变化的曲线如图所示:

回答下列问题:
(1)滤渣的主要成分为_________________________。
(2)“趁热过滤”的原因是______________________。
(3)在实验室做Na2CO3·H2O脱水实验,判断其脱水完全的方法是:__________。
(4)生产过程中“母液”____(填“能”或“不能”)循环使用。若不能,其原因是:_________。
(5)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g);ΔH1= +532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g);ΔH2= +473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用图中所示的装置进行实验,实验现象与预测不一致的是

| ①中的物质 | ②中的物质 | 预测现象 | |
| A | 浓氨水 | FeCl3溶液 | ②中有红褐色沉淀 |
| B | 浓氨水 | 浓盐酸 | ③中有白烟 |
| C | 浓硝酸 | 淀粉KI溶液 | ②中溶液为蓝色 |
| D | 饱和亚硫酸溶液 | 蓝色石蕊试液 | ②中溶液先变红又褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应N2O4(g)⇌2NO2(g)△H=57kJ•mol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )
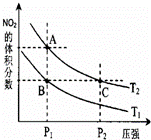
|
| A. | a、c两点的反应速率:a>c |
|
| B. | a、c两点气体的颜色:a深,c浅 |
|
| C. | 由状态b到状态a,可以用加热的方法 |
|
| D. | a、c两点气体的平均相对分子质量:a>c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com