
下列各组在溶液中反应,不管反应物的量是多少,都能用同一离子方程式表示的是( )
A.FeBr2与Cl2 B.Ba(OH)2与H2SO4
C.HCl与Na2CO3 D.NaHCO3与Ca(OH)2
【知识点】离子方程式的书写B1
【答案解析】B 解析:A.Cl2少量时,只有亚铁子被氧化,Cl2过量时,亚铁离子与溴离子均被氧化,则不能用同一离子方程式表示,故A不选;
B.无论量的多少都只发生Ba(OH)2+H2SO4═BaSO4↓+H2O,则能用同一离子方程式表示,故B选;C.HCl少量时,发生HCl+Na2CO3═NaHCO3+NaCl,HCl过量时发生2HCl+Na2CO3═NaCl+CO2↑+H2O,则不能用同一离子方程式表示,故C不选;D.NaHCO3少量时,发生NaHCO3+Ca(OH)2═CaCO3↓+H2O+NaOH,NaHCO3过量时发生2NaHCO3+Ca(OH)2═CaCO3↓+2H2O+Na2CO3,则不能用同一离子方程式表示,故D不选;
故答案选B
【思路点拨】本题考查与量有关的离子反应的书写,明确量对化学反应的影响是解答本题的关键,题目难度较大。


科目:高中化学 来源: 题型:
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物溶于水溶液呈碱性,下列结论不正确的是
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
| W | X | |
| Y | Z |
B.Z元素最高价氧化物对应水化物的酸性一定强于Y 元素
最高价氧化物对应水化物的酸性
C.Z元素单质在化学反应中只表现氧化性
D.X、Y、Z元素形成的单核阴离子半径最大的是Y
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L的密闭容器中发生反应xA(g)+yB(g) zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g) zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2

查看答案和解析>>
科目:高中化学 来源: 题型:
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
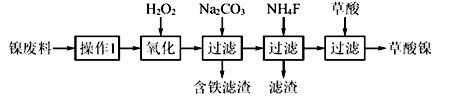
(1)操作1为 。
(2)生产过程中多次进行过滤,实验室进行过滤操作中需用到玻璃棒,下列实验操作中哪些操作中玻璃棒的作用完全相同的是 (填选项字母)。
①配制0.1mol/L的H2SO4溶液
②测定Na2CO3溶液的pH
③用KI淀粉试纸检验溶液中的氧化性离子
④加热食盐溶液制备NaCl晶体
⑤配制20%的KNO3溶液
A.①⑤ B.②③ C.④⑤ D.①④
(3)加入H2O2发生的主要反应的离子方程式为 ;
加入Na2CO3溶液调pH至4.0~4.5,其目的为 ;
加入NH4F后除掉的杂质是 。
(4)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧三小时,制得Ni2O3,同时获得混合气体。草酸镍受热分解的化学方程式为 。
(5)工业上还可用电解法制取Ni2O3。用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2SO4后采用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为 。amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为 。
(6)电解法制取Ni2O3的实际过程中,有时获得一种结晶水合物,已知含1molNi的该物质中含有0.5mol结晶水。取该化合物20.2g进行充分加热,获得Ni2O3固体和0.2mol水,则该结晶水合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.16g CH4与18 g NH4+ 所含质子数相等
B.1mol 苯分子中含有碳碳双键数为3NA
C.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22. 4L
D.等物质的量的甲基(—CH3)和羟基(—OH)所含电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
将Mg、Cu组成的混合物26.4g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是 ( )
A.43.2g B. 46.8g C. 53.6g D. 63.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2 CO3溶液中逐滴加入含等物质的量HCl的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2
C.等质量的Na HCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2 CO3饱和溶液中通入CO2,有Na HCO3结晶析出
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题。
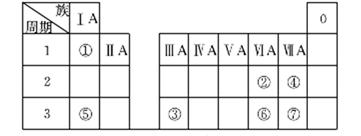
(1)④、⑤、⑦的原子半径由大到小的顺序为______________(用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为________>__________
(3)④、⑥、⑦的气态氢化物的稳定性由弱到强的顺序是_______________。
(4)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列生产或实验事实引出的相应结论不正确的是( )
| 选项 | 事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
| B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
| C | 在容积可变的密闭容器中发生反应:2NH3(g)⇌N2H4(l)+H2(g),把容积的体积缩小一半 | 正反应速率加快,逆反应速率减慢 |
| D | A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com