
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物溶于水溶液呈碱性,下列结论不正确的是
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
| W | X | |
| Y | Z |
B.Z元素最高价氧化物对应水化物的酸性一定强于Y 元素
最高价氧化物对应水化物的酸性
C.Z元素单质在化学反应中只表现氧化性
D.X、Y、Z元素形成的单核阴离子半径最大的是Y
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.
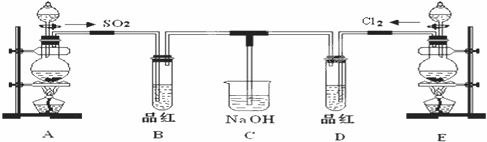
(1)实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能: ▲ ;
(2)实验室用装置E制备Cl2,其反应的化学方程式为:MnO2+4HCl(浓) MnCl2
MnCl2
+Cl2↑+2H2O.若有0.6 mol的HCl参加反应,则转移的电子总数为 ▲ mol;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B: ▲ ,D: ▲ ;
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象是:
B: ▲ ,D: ▲ ;
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用化学方程式表示): ▲ 。
如果用0.01 mol SO2与0.01 mol Cl2同时非常缓慢地通入100 mL水中,假如得到的溶液体积仍为100 mL,则所得溶液中氢离子的物质的量浓度约为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 1mol氧的质量是16g•mol﹣1 | B. | Na+的摩尔质量是23g•mol﹣1 |
|
| C. | CO2的摩尔质量是44g | D. | 氢的摩尔质量是2g•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
①在天平上称出27.8g绿矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解
②把制得的溶液小心地注入500mL容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度1~2cm处.改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为(填序号) ①②④③⑤ .
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是
500mL容量瓶 、 胶头滴管 .
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会 偏高 (填“偏高”、“偏低”或“无影响”).
(4)若出现如下情况,所配溶液浓度将偏高还是偏低:没有进行操作步骤④,会 偏低 ;加蒸馏水时不慎超过了刻度,会 偏低 .向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,会 偏低 .
(5)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应 重新配制 .

查看答案和解析>>
科目:高中化学 来源: 题型:
钠铝合金(常温液态)可作为核反应堆的载热介质。下列说法正确的是
A该合金的熔点高于金属钠的熔点
B.若将钠铝合金投入水中得到无色溶液且无固体剩余,则n(Al)>n(Na)
C.若将钠铝合金投入FeCl3溶液中有Fe(OH)3沉淀生成
D.等质量的钠铝合金中铝的含量越大,与足量盐酸反应时放出的氢气越少
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

(1)若A是淡黄色固体,B是气态氢化物,C、D是氧化物,C是造成酸雨的主要物质,写出
反应④的化学方程式__________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式: __________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:__________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。D的化学式是______。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。简述检验溶液D中金属阳离子的操作方法及现象:
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1 mol·L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时都会引起
A.CH3COOH电离程度变大 B.溶液pH减小
C.溶液的导电能力减弱 D.溶液中c(H+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,体积为1 L的密闭容器中发生如下反应:
SiF4(g)+2H2O(g)  SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1
SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1
(1)下列各项中能说明该反应已达化学平衡状态的是________(填字母序号)。
a.v消耗(SiF4)=4v生成(HF) b.容器内气体压强不再变化
c.容器内气体的总质量不再变化 d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:_________________________________________________________________________。
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应________(填序号)。
a.一定向正反应方向移动 b.一定向逆反应方向移动
c.一定是减小压强造成的 d.一定是升高温度造成的 e.SiF4的平衡转化率一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组在溶液中反应,不管反应物的量是多少,都能用同一离子方程式表示的是( )
A.FeBr2与Cl2 B.Ba(OH)2与H2SO4
C.HCl与Na2CO3 D.NaHCO3与Ca(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com