
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.
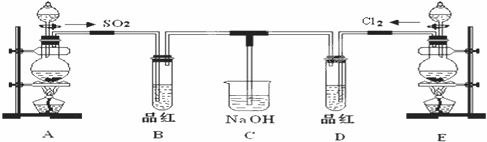
(1)实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能: ▲ ;
(2)实验室用装置E制备Cl2,其反应的化学方程式为:MnO2+4HCl(浓) MnCl2
MnCl2
+Cl2↑+2H2O.若有0.6 mol的HCl参加反应,则转移的电子总数为 ▲ mol;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B: ▲ ,D: ▲ ;
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象是:
B: ▲ ,D: ▲ ;
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用化学方程式表示): ▲ 。
如果用0.01 mol SO2与0.01 mol Cl2同时非常缓慢地通入100 mL水中,假如得到的溶液体积仍为100 mL,则所得溶液中氢离子的物质的量浓度约为 ▲ 。
科目:高中化学 来源: 题型:
纳米材料”(1 nm=10-9m )是指研究开发直径为几纳米至几十纳米的材料。如将“纳米材料”分散到某液体中,对于所得分散系的叙述不正确的是
A.光束通过此分散系时会形成一条光亮的“通路”
B.此分散系中“纳米材料”的粒子在做不停的、无序的运动
C.用滤纸过滤的方法可以从此分散系中分离得到该“纳米材料”
D.在外加电场作用下,“纳米材料”的粒子可能向某一极做定向运动
查看答案和解析>>
科目:高中化学 来源: 题型:
将淀粉水解,并用新制的氢氧化铜悬浊液检验其水解产物的实验中,要进行的主要操作是
①加热 ②滴入稀硫酸 ③加入新制的氢氧化铜悬浊液 ④加入足量的氢氧化钠溶液.
A.①→②→③→④→① B.②→①→④→③→①
C.②→④→①→③→① D.③→④→①→②→①
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是
A.与NaOH反应的氯气一定为0.3 mol
B.若反应中转移的电子为n mol,则0.15<n<0.25
C.n(Na+):n(Cl-)可能为7:3
D.n(NaCl):n(NaClO):n(NaClO3)可能为8:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验的操作和所用的试剂都正确的是( )
A.要鉴别己烯中是否混有少量甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液
B.配制浓硫酸和浓硝酸的混酸时,将浓硝酸沿壁缓缓倒入到浓硫酸中
C.除去溴苯中少量的溴,可以加水后分液
D.制硝基 苯时,将盛有混合液的试管直接在酒精灯火焰上加热。
苯时,将盛有混合液的试管直接在酒精灯火焰上加热。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐
B.已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.01%
C.0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液等体积混合,则溶液中:
2c(H+) + c(CH3COOH) = 2 c(OH-) + c(CH3COO-)
D.在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物溶于水溶液呈碱性,下列结论不正确的是
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
| W | X | |
| Y | Z |
B.Z元素最高价氧化物对应水化物的酸性一定强于Y 元素
最高价氧化物对应水化物的酸性
C.Z元素单质在化学反应中只表现氧化性
D.X、Y、Z元素形成的单核阴离子半径最大的是Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com