
科目:高中化学 来源: 题型:
下图中a曲线表示一定条件下可逆反应
X(g)+Y(g)====2Z(g)+W(s) △H<0的反应过程。若使a曲线变为b曲线,可采用的措施是
A.升高温度 B.增大Y的浓度
C.降低温度 D.增大体系压强
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,将22.4 L HCl完全溶于1 L水中(水的密度近似为1 g/mL),溶液的密度为ρ g/cm3,溶液的体积为V mL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
①w=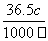 ×100% ②c=1 mol·L-1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w ④所得溶液中含有NA个HCl分子
×100% ②c=1 mol·L-1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w ④所得溶液中含有NA个HCl分子
A.全部 B.①③④ C.①③ D.只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
只改变一个影响因素,下列关于平衡常数K与化学平衡移动的关系叙述错误的是
A.K值不变,平衡可能移动 B.平衡移动,K值一定变化
C.平衡移动,K值可能不变 D. K值变化,平衡一定移动
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g)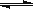 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ▲ ,△H ▲ 0(填“<”“ >”“ =”);
(2) 830℃时,向一个 5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1。,则6s时c(A)= ▲ mol·L-1,C的物质的量为 ▲ mol;反应经一段时间后达到平衡,此时A的转化率为 ▲ ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ▲ ;
(3)判断该反应是否达到平衡的依据为 ▲ (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时间改变 d.单位时间里生成C和A的物质的量相等
(4)1200℃时反应C(g)+D(g)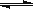 A(g)+B(g)的平衡常数的值为 ▲ 。
A(g)+B(g)的平衡常数的值为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列排列的顺序不正确的是
A.离子半径:O2->Na+ >Mg2+ B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.热稳定性:HCl>PH3>H2S D.结合氢离子能力:CO32->HCO3->SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.
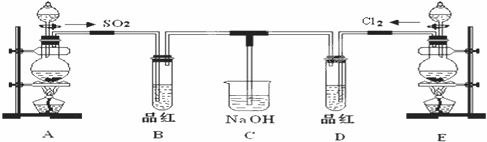
(1)实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能: ▲ ;
(2)实验室用装置E制备Cl2,其反应的化学方程式为:MnO2+4HCl(浓) MnCl2
MnCl2
+Cl2↑+2H2O.若有0.6 mol的HCl参加反应,则转移的电子总数为 ▲ mol;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B: ▲ ,D: ▲ ;
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象是:
B: ▲ ,D: ▲ ;
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用化学方程式表示): ▲ 。
如果用0.01 mol SO2与0.01 mol Cl2同时非常缓慢地通入100 mL水中,假如得到的溶液体积仍为100 mL,则所得溶液中氢离子的物质的量浓度约为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 1mol氧的质量是16g•mol﹣1 | B. | Na+的摩尔质量是23g•mol﹣1 |
|
| C. | CO2的摩尔质量是44g | D. | 氢的摩尔质量是2g•mol﹣1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com