
NA���������ӵ����������������������
A��10mL��������Ϊ98%��H2SO4����ˮϡ����100mL��H2SO4��������������9.8%
B����H2O2��Cl2��2HCl��O2��Ӧ�У�ÿ����32g��������ת�Ƶ��Ӹ���Ϊ2moL
C����״���£�������ΪNA��CO��C2H4����������ԼΪ22.4L������Ϊ28g
D�� ij��ɫ��Һ��ͨ��Cl2����Һ��Ϊ�ػ�ɫ���ټ��������Һ����Һ��Ϊ��ɫ��˵��ԭ��Һ�д���I-
 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ڴ����ᴿ������˵������ȷ����(����)
A���ܽ����ʱ��Ӧ��������ҺϡЩ����ֹʳ�β���ȫ�ܽ�
B����ȥ���������ʺ���Һ���������ڼ���Ũ��
C����������ʣ������Һ��ʱ��ֹͣ���ȣ��������Ƚ�Һ������
D�����Ƶþ���ת�Ƶ����ƹ�������������ˮ���ж��ϴ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�г������۵ġ�84������Һ������Ʒ��ʶ���������������ٱ�ƷΪ��ɫҺ�壬�ʼ��Ԣ�ʹ��ʱ��ˮϡ�͢ۿɶԲ;ߡ����������������Ư��dzɫ�������Ч�ɷֿ�����( )
A. Cl2 B. SO2 C. NaClO D. KMn04
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ڷ�ӦKCl03+ HCl �� KC1 + Cl2 ��+ H20��δ��ƽ������0��1 mol KCl03 �μӷ�Ӧ������˵����ȷ���� ( )
A��ת��0��5 mol���� B������0��1 mol Cl2
C����������HC1Ϊ0��6 mol D��Cl2��ֻ���������ﲻ�ǻ�ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������������Ҫ������������ԭ��������ˮ��Һ�ֳ�Ϊ˫��ˮ��������������ɱ����Ư�ȡ�ij��ѧ��ȤС��ȡһ�����Ĺ���������Һ��ȷ�ⶨ�˹�������ĺ�������̽���˹�����������ʡ�
�ⶨ�������ĺ���������д���пհף�
��1�� ��ȡ10.00 ml�ܶ�Ϊ�� g/mL�Ĺ���������Һ���ձ���ȫ������ת�Ƶ�250 ml �����������ƣ��У���ˮ�������̶ȣ�ҡ�ȡ���ȡϡ�ͺ�Ĺ���������Һ25. 00mL����ƿ�У�����ϡ�����ữ��������ˮϡ�ͣ�������������
��2���ø�����ر���Һ�ζ������������䷴Ӧ�����ӷ���ʽ���£��뽫������ʵĻ�ѧ����������ѧʽ��д�ڷ����

 MnO4����
MnO4����
 H2O2��
H2O2��
 H��=
H��=
 Mn2����
Mn2����
 H2O��
H2O��



��3���ζ�ʱ����������ر���Һע�� �����ʽ����ʽ�����ζ����С��ζ������յ�������� ��
��4�����ζ����Σ�ƽ������c mol/L KMnO4����ҺV mL����ԭ����������Һ�й����������������Ϊ ��
��̽���������������
�û�ѧ��ȤС��������ṩ��ʵ���������������ʵ�飬�ֱ�֤���˹�������������ԺͲ��ȶ��ԡ���ʵ���������Լ�ֻ�й���������Һ����ˮ���⻯���ݷ���Һ������������Һ��ʵ����������Ʒ����ѡ�����뽫���ǵ�ʵ�鷽����ʵ�����������±���
| ʵ �� �� �� | ʵ �� �� �� | ʵ �� �� �� |
| ��֤������ | ||
| ��֤���ȶ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ָ����Һ��һ���ܴ����������
�ټ���Al�ܷų�H2����Һ�У�Fe2����Al3����NO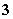 ��Cl����S2��
��Cl����S2��
����pH��11����Һ�У�Na����[Al(OH)4]����NO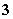 ��S2����SO
��S2����SO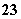
����ˮ�����c(H��)��10��12mol��L��1����Һ�У�Cl����HCO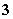 ��NO
��NO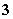 ��NH
��NH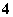 ��F��
��F��
�ܼ���Mg�ܷų�H2����Һ�У�Mg2����NH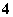 ��Cl����K����SO
��Cl����K����SO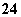
A���ڢ� B���٢ڢ� C���٢ۢ� D���٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ������Fe��Fe2O3�����Ͷ��250ml 2mol/L��HNO3��Һ�У���Ӧ��ȫ������ʣ�࣬����1��12L NO���壨�����������Ӧ����Һ�м���1 mol/L��NaOH��Һ��Ҫʹ��Ԫ��ȫ����������������NaOH��Һ�����������
A��450ml B��500ml C��400ml D����ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������Ȼ���еIJ���ѭ����ϵ���¡�
 |
��1��H2S�ڿ����п���ȼ�ա�
��֪�� 2H2S(g) + O2(g)  2S(s) + 2H2O(g) ��H= ��442.38 kJ/mol
2S(s) + 2H2O(g) ��H= ��442.38 kJ/mol
S(s) + O2(g)  SO2(g) ��H= ��297.04 kJ/mol
SO2(g) ��H= ��297.04 kJ/mol
H2S(g)��O2(g)��Ӧ����SO2(g)��H2O(g)���Ȼ�ѧ����ʽ�� ��
��2��SO2�Ǵ�����Ⱦ���ˮ�������õ�����SO2����������������¡�
�� SO2���ں�ˮ����H2SO3��H2SO3���ջ�����SO32��������뷽��ʽ�� ��
�� SO32�����Ա���ˮ�е��ܽ�������ΪSO42������ˮ��pH�� ������ߡ� �������䡱���͡�����
�� Ϊ������ˮ��pH���ɼ������ʵĺ�ˮ��ʹ���е�HCO3�����뷴Ӧ���䷴Ӧ�����ӷ���ʽ�� ��
�� ��������Ӧ��ͬʱ��Ҫ���������������ԭ���� ��
��3����Ȼ��ر���ԭ��ͭ�����ᆳ�������������ú���CuSO4��Һ���������������������ܵ�ZnS������ת��Ϊͭ����CuS�����û�ѧ�����ʾ��ZnSת��ΪCuS�Ĺ��̣� ��
��4��SO2��O2��H2SO4��Һ�п��Թ���ԭ��أ��为����Ӧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1.8 g H2O������ͬ��ԭ������H2SO4������Ϊ ��������
A��0.1 g B��0.2 g C��2.45 g D��4.9 g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com