按要求回答下列问题
(1)某元素的原子的价电子构型为4s24p1,该元素的符号为______.
(2)某元素+3价离子的3d轨道半充满,该元素的符号为______.
(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,A的离子结构示意图为______,B的元素名称为______.
(4)下列变化:H-(g)═H(g)+e-吸收的能力为73kJ/mol,H(g)═H+(g)+e-吸收的能力为1311kJ/mol,则氢负离子(H-)的第一电离能为______.
(5)N≡N的键能为942kJ/mol,N-N单键的键能为247kJ/mol,计算说明N2中的______键更稳定(填“σ”或“π”).
【答案】
分析:(1)元素元素价电子构型为4s
24p
1,处于P区,为主族元素,根据周期数=电子层数,族序数=最外层电子数确定在周期表中的位置,进而确定元素;
(2)元素+3价离子的3d轨道半充满,该离子的电子排布式为1s
22s
22p
63s
23p
63d
5,故原子的核电荷数为23+3=26,为Fe元素;
(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,核外电子数为18,A原子质子数为16,B原子质子数为20,故A为S元素,B为Ca元素;
(4)第一电离能为失去1个电子所吸收的能量;
(5)N≡N中含有1个σ键、2个π键,根据键能计算N≡N中π键的键能,键能越大越稳定.
解答:解:(1)元素元素价电子构型为4s
24p
1,处于P区,为主族元素,为第四周期第ⅢA族元素Ga,
故答案为:Ga;
(2)元素+3价离子的3d轨道半充满,该离子的电子排布式为1s
22s
22p
63s
23p
63d
5,故原子的核电荷数为23+3=26,为Fe元素,
故答案为:Fe;
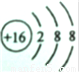
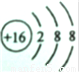
(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,核外电子数为18,A原子质子数为16,B原子质子数为20,故A为S元素,B为Ca元素,S
2-离子的结构示意图为:
,
故答案为:
,Ca;
(4)第一电离能为失去1个电子所吸收的能量,由H
-(g)═H(g)+e
-吸收的能力为73kJ/mol,可知氢负离子(H
-)的第一电离能为+73kJ/mol,
故答案为:73kJ/mol;
(5)N≡N中含有1个σ键、2个π键,N≡N的键能为942kJ/mol,N-N单键的键能为247kJ/mol,故N≡N中π键的键能为

(942kJ/mol-247kJ/mol)=347.5kJ/mol,键能越大越稳定,故π键稳定,
故答案为:π.
点评:考查核外电子排布规律、常用化学用语书写、化学键等,注意(5)中需要通过计算判断,不能想当然认为π键不稳定.

 ,
, ,Ca;
,Ca; (942kJ/mol-247kJ/mol)=347.5kJ/mol,键能越大越稳定,故π键稳定,
(942kJ/mol-247kJ/mol)=347.5kJ/mol,键能越大越稳定,故π键稳定,

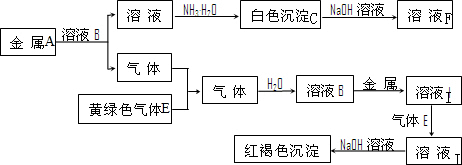
 A、B、C、D都是由短周期元素组成的常见物质,其中A、B、C均含同一种元素,在一定条件下相互转化关系如图所示(部分产物已略去).
A、B、C、D都是由短周期元素组成的常见物质,其中A、B、C均含同一种元素,在一定条件下相互转化关系如图所示(部分产物已略去). H++CN-、H2O
H++CN-、H2O H++OH-、CN-+H2O
H++OH-、CN-+H2O HCN+OH-
HCN+OH- H++CN-、H2O
H++CN-、H2O H++OH-、CN-+H2O
H++OH-、CN-+H2O HCN+OH-
HCN+OH-