
【题目】炼铁的矿物主要有赤铁矿、磁铁矿和菱铁矿等。目前主要采用以下流程测定铁矿石中铁元素的含量,流程分为两个环节:铁矿石预处理和重铬酸钾滴定。
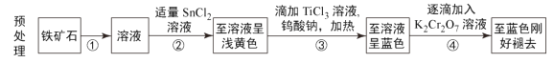
滴定过程:向预处理结束的溶液中加入适量蒸馏水和硫酸磷酸混合酸,滴加数滴二苯胺磺酸钠,用重铬酸钾标准溶液滴定,记录终点体积V。
已知:i.钨酸钠(Na2WO4)可用作指示剂,若钨由+6价变为+5价,则溶液变为蓝色。
ii.Sn2+和Ti3+均具有还原性。
iii.氧化性顺序为Cr2O72->Fe3+>WO42-。
iV.二苯胺磺酸钠可用作氧化还原指示剂,本身无色,被氧化后呈现紫红色。
请回答下列问题:
(1)①过程需要加入过量的___(填试剂名称),试剂过量的理由为___。
(2)②过程后的浅黄色溶液中铁的存在形式为___,③过程后的蓝色溶液中铁的存在形式为___。
(3)④过程中K2Cr2O7的作用为___。
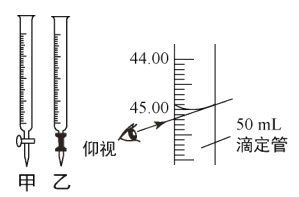
(4)滴定时,滴定管应选用___(填“甲”或“乙”);若滴定结束时,仰视读数,则测得结果___(填“偏大”“偏小”或“无影响”)
(5)滴定过程中,以二苯胺磺酸钠为指示剂,滴定终点观察到的现象为___。
(6)现称取0.4g铁矿石进行测定,滴定时共消耗45.00mL0.01mol·L-1K2Cr2O7溶液,则该铁矿石中铁的质量分数为___ %(保留1位小数)。
【答案】浓盐酸 使铁矿石完全溶解 Fe3+、Fe2+ Fe2+ 将+5价钨和Ti3+氧化除去 甲 偏大 溶液变为紫红色,且半分钟内不褪色 37.8
【解析】
铁矿石通过①过程得到溶液,①过程应加酸,鉴于后面流程中出现氯离子,则①过程加浓HCl得到含Fe2+、Fe3+的溶液;②过程加Sn2+将Fe3+还原为Fe2+,得到的溶液为浅黄色,说明浅黄色溶液中还含Fe3+;③过程加TiCl3和钨酸钠后呈蓝色,说明钨由+6价变为+5价,由于氧化性:Fe3+>WO42-,故③过程还将Fe3+还原成Fe2+,所加TiCl3应过量,铁元素以Fe2+形式存在于蓝色溶液中;由于氧化性顺序为Cr2O72->Fe3+>WO42-,那么还原性顺序为:+5价的钨>Fe2+,且④过程得到蓝色刚好褪去的溶液,说明④过程加K2Cr2O7将+5价钨氧化成+6价,铁元素继续以Fe2+形式存在于溶液中,据此解答。
(1)为加快铁矿石溶解,①过程应加浓度较大的盐酸,为使铁矿石完全溶解,浓盐酸应该过量,故答案为:浓盐酸;使铁矿石完全溶解;
(2)Sn2+具有还原性,②过程用Sn2+将Fe3+还原为Fe2+,但是得到的溶液为浅黄色,说明该溶液还有Fe3+,③过程后的溶液呈蓝色,说明有+6价钨变为了+5价,因为氧化性Fe3+>WO42-,故该过程Fe3+被还原成了Fe2+,故答案为:Fe3+、Fe2+;Fe2+;
(3)③过程得到的蓝色溶液除Fe2+外还有+5价的钨、Ti3+都具有还原性,都能和重铬酸钾溶液反应,若直接滴定,会使滴定结果偏大,故过程④加K2Cr2O7应是将+5价钨和Ti3+除去,故答案为:将+5价钨和Ti3+氧化除去;
(4)重铬酸钾溶液是强氧化性溶液,会腐蚀乳胶管,故选用酸式滴定管甲,若滴定结束时仰视读数,则导致重铬酸钾溶液读数偏大,测得结果偏大,故答案为:甲;偏大;
(5)当到达终点时,Fe2+反应完,二苯胺磺酸钠随即被氧化,溶液呈现紫红色,且半分钟内不褪色,故答案为:溶液变为紫红色,且半分钟内不褪色;
(6)由上面分析可知,滴定时,Fe2+和Cr2O72-发生氧化还原反应得到Fe3+和Cr3+,根据得失电子守恒有:6Fe2+~6Fe3+~6e-~Cr2O72-~2Cr3+。滴定时,n(Cr2O72-)=0.01mol·L-1×45.00mL×10-3=4.5×10-4mol,所以,Fe元素的物质的量n(Fe)=![]() =2.7×10-3mol,则m(Fe)= 2.7×10-3mol×56g/mol=0.1512g,Fe%=
=2.7×10-3mol,则m(Fe)= 2.7×10-3mol×56g/mol=0.1512g,Fe%=![]() =37.8%,故答案为:37.8。
=37.8%,故答案为:37.8。


科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O ,相对分子质量为288)易溶于水,是一种很好的补铁剂,可由乳酸[CH3CH(OH)COOH]与FeCO3反应制得。I.碳酸亚铁的制备(装置如图所示)

(1)仪器B的名称是______;实验操作如下:打开k1、k2,加入适量稀硫酸,关闭k1,使反应进行一段时间,其目的是______。
(2)接下来要使仪器C中的制备反应发生,需要进行的操作是______,其反应的离子方程式为______。
(3)仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是____。
Ⅱ乳酸亚铁的制备及铁元素含量测定
(4)向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在______的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于100%,其原因可能是______
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成100mL溶液。吸取 25.00mL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0.100 mol·L-1硫代硫酸钠溶液滴定(已知: I2+2S2O32-=S4O62-+2I-),当溶液______ ,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24.80 mL,则样品纯度为______ %保留1位小数 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于硝酸的认识,不正确的是![]()
![]()
A. 浓硝酸在见光或受热时会发生分解 B. 久置的浓硝酸会变为稀硝酸
C. 金属与硝酸反应不产生氢气 D. 稀硝酸与铁反应而浓硝酸不与铁反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短同期主族元素X、Y、Z、W的原子序数依次增大。Z的简单离子半径在同周期中最小,25 ℃时, 0.01 molL 1 X、W的最高价氧化物对应的水化物溶液的pH和原子半径的关系如图所示,Y和W 同主族。下列说法错误的是 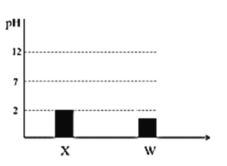
A.原子半径的大小顺序为Z>W>X>Y
B.元素Y分别与X、W元素至少形成两种化合物
C.Y、Z形成的化合物既能和酸反应又能和碱反应
D.X、Y、W对应的简单氢化物中,X的氢化物最稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(V)是人体必需的微量元素,能预防突发性心脏病等疾病,其常见化合价有+2、+3、+4、+5,实验室模拟工业生产制备V2(CO3)3的步骤如下:
I.取18.20gV2O5放入水中搅拌形成悬浊液,在酸性条件下,通入二氯化硫充分反应可得V2(SO4)3溶液;
II.将V2(SO4)3溶液与足量的碳酸钠溶液混合,充分反应后过滤,洗涤、干燥,得V2(CO3)3固体22.56g。
已知:+5价V具有氧化性,+3价V具有还原性,易被氧气氧化。
回答下列问题:
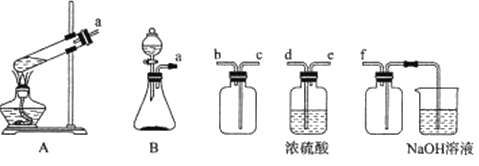
(1)实验室用Na2SO3固体和H2SO4(浓)制取SO2,可选用的发生装置是_____(填“A”或“B”),利用下述装置制取并收集干燥的SO2,连接顺序为a—____—____—____—_____—f。
(2)步骤I的装置如下;
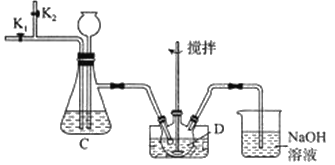
①盛放V2O5的仪器D的名称是_____,装置C中长颈漏斗的作用是_______。
②通入二氧化硫前和实验结束后都要通入N2,目的是________。
③写出步骤I中反应的离子方程式:___________。
(3)步骤II的洗涤操作中,证明已经洗净的方法是_________;实验中V2(CO3)3的产率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.60g冰醋酸和果糖的混合物中含氧原子的数目为2NA
B.标准状况下,33.6LCHCl3中含有的共价键的数目为6NA
C.常温下,将2.7gAl投入足量的浓硝酸中,转移电子数为0.3NA
D.78gH2SiO3胶体中含有的胶粒数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
A.常温常压下,1.7gNH3含有NA个电子
B.标准状况下,22.4L水中含H2O分子NA个
C.1molNa完全反应生成NaCl时,失去NA个电子
D.常温常压下,22.4LCO2中含有的CO2分子数小于NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。
(1)以下操作顺序不合理的是 _______。
A.②⑤④③① B.④⑤②①③ C.⑤②④①③ D.⑤④②①③
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除天平、药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)通过步骤①中过滤后的滤液,检验SO42-是否除尽的操作方法是_________________________
Ⅱ.向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。回答下列问题:

(1)图1中通入CO2后所得溶液的溶质成分为____________________;
(2)图3中通入CO2后所得溶液的溶质成分为____________________。
Ⅲ.已知氮化镁极易与水反应:Mg3N2+6H2O===2NH3↑+3Mg(OH)2↓。将足量的镁条置于空气燃烧,可能会发生下列反应①2Mg+O2![]() 2MgO;②3Mg+N2
2MgO;②3Mg+N2![]() Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2![]() 2MgO+C;④Mg+H2O(g)
2MgO+C;④Mg+H2O(g)![]() MgO+H2。请设计一个实验,验证产物中含有氮化镁(Mg3N2):_________________________。
MgO+H2。请设计一个实验,验证产物中含有氮化镁(Mg3N2):_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com