
【题目】某化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol·L﹣1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.
反应阶段 | Ⅰ | Ⅱ | Ⅲ |
稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
现 象 | 无气体 | 有气体 | 无气体 |
则混合溶液中c(HCO3﹣)为( )
A. 1.00mol·L﹣1 B. 0.50mol·L﹣1 C. 1.50mol·L﹣1 D. 2.00mol·L﹣1
【答案】A
【解析】
第Ⅰ阶段无气体生成说明盐酸滴入溶液中发生的是碳酸根离子和氢离子生成碳酸氢根离子的过程,反应为CO32-+H+=HCO3-,消耗盐酸体积10ml,碳酸钠全部转化为碳酸氢钠,氯化氢物质的量为:0.010ml×1.00molL-1=0.01mol,则反应生成碳酸氢根离子的物质的量为0.01mol,第Ⅱ阶段发生反应:HCO3-+H+=H2O+CO2↑,则参加反应的碳酸氢根离子的总物质的量为:(0.04L-0.01L)×1.00mol/L=0.03mol,则原溶液中碳酸氢根离子的物质的量为:0.03mol-0.01mol=0.02mol,所以原混合液中碳酸氢根离子的浓度为:c(HCO3-)=![]() =1mol/L,故选A。
=1mol/L,故选A。


科目:高中化学 来源: 题型:
【题目】下列能用勒沙特列原理解释的是( )
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.棕红色NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
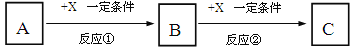
(1)若X是空气中存在的强氧化性无色气体单质,则A可能是___________(填序号)
a.C b.N2 c.S d.Al
(2)若X是日常生活中最常用的金属单质,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在气体A中燃烧产生棕黄色的烟。
B的化学式为____________; 反应②的化学方程式为:___________________,
C溶液中加入NaOH溶液后产生的现象是_________________________, 方程式为____________________________________、_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量溴乙烷的装置如下图所示。根据题意完成下列填空:
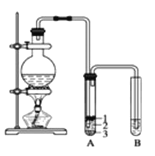
(1)盛放反应物的仪器名称是________,其中加入的反应物是溴化钠、 和 1∶1的硫酸。
(2)将生成物导入盛有冰水混合物的试管 A中,冰水混合物的作用是_____________。试管 A中的物质分为三层(如图所示),产物在第___________层。
(3)试管 A中除了产物和水之外,还可能存在_________、________(写出化学式)。
(4)用浓的硫酸进行实验,若试管 A中获得的有机物呈棕黄色,除去其中杂质的正确方法是______(选填编号)。
a.蒸馏
b.用氢氧化钠溶液洗涤
c.用四氯化碳萃取
d.用亚硫酸钠溶液洗涤
(5)若试管 B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外接电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
铅蓄电池:Pb(s)+PbO2(s)+2H2SO4(aq)==2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下各组判断正确的是( )
铅蓄电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用铁片和稀硫酸反应制氢气时,下列措施不能使氢气生成速率加快的是( )
A.水浴加热
B.将稀硫酸改为98%的浓硫酸
C.滴加少许CuSO4溶液
D.改用铁粉并振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个2L的密闭容器中投入反应物,发生反应2SO3(g)![]() 2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
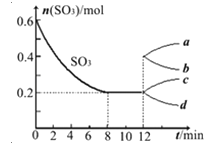
(1)根据8min时到达平衡,算出该反应的平衡常数值为 。
(2)用O2表示0到8min内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
A、v(SO3)=2v(O2)
B、容器内压强保持不变
C、v(SO2)逆=2v(O2)正
D、容器内密度保持不变
(4)在第12min时,容器压缩到1L,则SO3的变化曲线为 。
A、a B、b C、c D、d
(5)若保持容积不变在第12min时,加入SO3(g),则平衡向 反应方向移动(填“正”或“逆”)。SO3的体积分数 (填“增大”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是五种短周期原子序数依次递增的主族元素,乙、丁、戊在周期表的相对位置如右图。甲能与丙形成四核10电子的分子,则下列说法正确的是( )
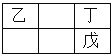
A. 丙的非金属性强,丙单质的氧化性也强
B. 甲与乙、甲与丁都能形成原子个数比1: 1和2:1的分子
C. 丁的氢化物沸点高于戊的氢化物沸点说明丁的非金属性比戊强
D. 简单阴离子还原性:丁>戊,简单阴离子半径:丁>丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com