
【题目】下列能用勒沙特列原理解释的是( )
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.棕红色NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】将1 mol I2(g)和2 mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
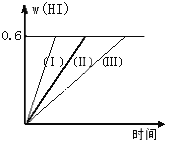
(1)达平衡时,I2(g)的物质的量浓度为____________________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ)所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示。则甲条件可能是____________,则乙条件可能是_____________ 。(填入下列条件的序号)
①恒容条件下,升高温度;②恒容条件下,降低温度;③恒温条件下,缩小反应容器体积;
④恒温条件下,扩大反应容器体积;⑤恒温恒容条件下,加入适当催化剂。
(3)若保持温度不变,在另一个相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.6,则a、b、c的关系是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组混合物:①CCl4和NaCl的混合液;②苯(沸点:80.1℃)和甲苯(沸点:110.6℃)的混合溶液(苯和甲苯是性质非常相似的一对互溶液体);③掺有碘化钾的碘水,分离以上各混合液的正确方法依次是
A. 分液、蒸馏、萃取 B. 萃取、蒸馏、分液
C. 蒸馏、萃取、分液 D. 分液、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器使用正确的是
A. 在表面皿蒸发浓缩NaCl溶液
B. 用带玻璃塞的试剂瓶盛盐酸
C. 使用漏斗、滤纸、玻璃棒等进行过滤实验
D. 配制100mL浓度为0.10 mol·L-1NaCl溶液时,在容量瓶中溶解、定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。
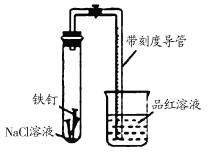
(1) 实验前用碱液清洗铁钉,再用0.100 mol/L的 H2SO4溶液浸泡至有气泡产生。用H2SO4溶液浸泡的目的是_________ _____。
(2) 为尽量减小误差,下列操作的正确顺序是 ___(填序号)。
①装入铁钉
②插入注射器向铁钉表面滴入适量NaCl溶液并打开止水夹
③将导管口浸入品红溶液
④塞上单孔活塞
⑤检查装置气密性
(3)实验中试管内发生的总反应化学方程式为 ;
用该实验方案测量空气中O2的体积百分数时应测量的数据是:
①导管与试管内部空间总体积,② _。
(4) 实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析,请补充写出假设三:
假设一:电解质溶液的pH
假设二:NaCl溶液的浓度
假设三:________________
(5)借助上述实验装置,通过调节溶液的pH验证假设一,获得了如下实验数据:
pH | 2.0 | 5.5 | 6.0 | 6.5 | 7.0 | 8.0 |
液柱高度 | 0 cm | 1.3 cm | 8.5 cm | 8.4 cm | 8.5 cm | 8.5 cm |
形成稳定 液柱时间 | 3.0 min | 3.1 min | 5.1 min | 5.3 min | 15.6 min | min |
①当pH=2时,没有观察到稳定液柱形成的原因是_____________________。
②根据实验数据分析,为缩短实验测定时间,pH的最佳范围是________________。
③按上述实验装置,设计实验证明假设二。
第一步:配制不同浓度的NaCl溶液;
第二步:____________________,分别用注射器将NaCl溶液滴入铁钉表面;
第三步:记录形成稳定液柱所用时间和液柱的高度,比较分析数据得出结论。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol·L﹣1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.
反应阶段 | Ⅰ | Ⅱ | Ⅲ |
稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
现 象 | 无气体 | 有气体 | 无气体 |
则混合溶液中c(HCO3﹣)为( )
A. 1.00mol·L﹣1 B. 0.50mol·L﹣1 C. 1.50mol·L﹣1 D. 2.00mol·L﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com