
【题目】下列仪器使用正确的是
A. 在表面皿蒸发浓缩NaCl溶液
B. 用带玻璃塞的试剂瓶盛盐酸
C. 使用漏斗、滤纸、玻璃棒等进行过滤实验
D. 配制100mL浓度为0.10 mol·L-1NaCl溶液时,在容量瓶中溶解、定容
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A. 用排水法收集铜粉与浓硝酸反应产生的NO2
B. 用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液
C. 用酸性KMnO4溶液验证草酸的还原性
D. 用饱和NaHCO3溶液除去Cl2中混有的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L FeCl3溶液与0.2L 1mol/L KCl溶液中的Cl﹣的物质的量浓度之比( )
A.5:2
B.3:1
C.15:2
D.1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物有广泛的用途。
(1)C(s)+H2O(g)![]() CO(g) +H2(g) ΔH= +131.3 kJ·mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
CO(g) +H2(g) ΔH= +131.3 kJ·mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
A.升高温度 B.增加碳的用量
C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+ CO2(g)![]() 2CO(g) △H=+172.5kJ·mol-1
2CO(g) △H=+172.5kJ·mol-1
则CO(g)+H2O(g)![]() CO2(g)+H2(g)的△H= 。
CO2(g)+H2(g)的△H= 。
(3)CO与H2在一定条件下可反应生成甲醇,甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
t / min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
①其他条件不变,降低温度,反应达到新平衡前v(逆)________v(正)(填“>”、“<”、“=”)
②该温度下此反应的平衡常数K=___________
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数___________(填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒沙特列原理解释的是( )
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.棕红色NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在恒温条件下,将一定量X和Y的混合气体通入一容积为2 L的密闭容器中,X和Y两物质的浓度随时间变化情况如下图。
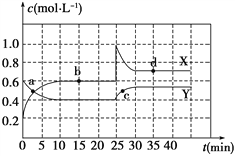
(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示):____________________。
(2)0~10min化学反应速度V(X)=__________________。
(3)比较Y在0~10min和10~20min时平均反应速率的大小:v(0~10)_______ v(10~20)(填“<”、“>”或“=”),原因是________________。
(4) a、b、c、d四个点中,表示化学反应处于平衡状态的点是_________,理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2 L的密闭容器中充入2 mol A和1 mol B,在一定条件下发生反应:2A(g)+B(g)![]() 3C(g)经2 s达到平衡后,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g)经2 s达到平衡后,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol /(L·s)
②用物质B表示该反应的平均反应速率为0.2 mol /(L·s)
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
⑤其它条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
A.①②③ B.①③⑤ C.②④⑤ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外接电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
铅蓄电池:Pb(s)+PbO2(s)+2H2SO4(aq)==2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下各组判断正确的是( )
铅蓄电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com