
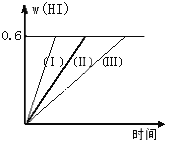
����Ŀ����1 mol I2(g)��2 mol H2����2L�ܱ������У���һ���¶��·�����Ӧ��I2(g) + H2(g) ![]() 2HI(g)����H��0������ƽ����HI���������w(HI)��ʱ��仯��ͼ����(��)��ʾ��
2HI(g)����H��0������ƽ����HI���������w(HI)��ʱ��仯��ͼ����(��)��ʾ��
��1����ƽ��ʱ��I2(g)�����ʵ���Ũ��Ϊ____________________��
��2�����ı䷴Ӧ�������ڼ�������w(HI)�ı仯������(��)��ʾ������������w(HI)�ı仯������(��) ��ʾ���������������____________����������������_____________ ��������������������ţ�
�ٺ��������£������¶ȣ��ں��������£������¶ȣ��ۺ��������£���С��Ӧ���������
�ܺ��������£�����Ӧ����������ݺ��º��������£������ʵ�������
��3���������¶Ȳ��䣬����һ����ͬ��2L�ܱ������м���a mol I2(g)��b mol H2(g)��c mol HI��a��b��c������0����������Ӧ����ƽ��ʱ��HI�����������Ϊ0.6����a��b��c�Ĺ�ϵ��____________��
���𰸡� 0.05mol��L��1 �ۢ� �� (a��c/2)/(b��c/2)=1/2
�������������������1���÷�Ӧ��һ����Ӧǰ�������������Ļ�ѧ��Ӧ�����Է�Ӧ������������ʵ�����3mol��ͬһ�����и����������������������ʵ�������������ƽ��ʱ�⻯������ʵ���=3mol��0.6=1.8mol����μӷ�Ӧ��n��I2��=0.5n��HI��=0.5��1.8=0.9mol��ʣ���n��H2��=1-0.9=0.1mol������ƽ��ʱc��H2��=![]() =0.05mol/L���ʴ�Ϊ��0.05mol/L��
=0.05mol/L���ʴ�Ϊ��0.05mol/L��
��2���ڼ�������w��HI���ı仯�����ߣ����� ��ʾ����Ӧʱ�����̣��⻯��ĺ������䣬˵��������ֻ�����˷�Ӧ���ʲ�Ӱ��ƽ�⣬����ѹǿ����С��Ӧ����������ͼ�������Ը÷�Ӧƽ����Ӱ�죬��������Ӧ���ʣ����̷�Ӧʱ�䣻����������w��HI���ı仯�����ߣ����� ��ʾ����Ӧʱ��䳤���⻯��ĺ������䣬˵����Ӧ���ʼ�С��ƽ�ⲻ�ƶ��������Ǽ�Сѹǿ������������������ʴ�Ϊ���ۢ�������
��3���������¶Ȳ��䣬����һ����ͬ��2L�ܱ������м���a mol I2��g����b mol H2��g����c mol HI��a��b��c������0����������Ӧ����ƽ��ʱ��HI�����������Ϊ0.6����ԭ����ƽ���ǵ�Чƽ�⣬���º��ݣ�ǰ������������仯������ѧ������ת������ߣ�������ԭ������ķ�Ӧ�����ʵ���������ȼ��ɣ�
I2��g�� + H2��g��![]() 2HI��g����
2HI��g����
��ʼ��mol����a b c
�仯��mol����0.5c 0.5c c
ƽ�⣨mol����a+0.5c b+0.5c 0
��a+0.5c ������ b+0.5c��=1��2������4a+c=2b���ʴ�Ϊ��4a+c=2b��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Fe 2 (SO 4 ) 3 ��Al 2 (SO 4 ) 3 �Ļ����Һ�У���μ���NaOH��Һ������������ͼ���У�����ȷ��ʾ������Ӧ����

A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��O2��ȼ��������̬H2O�ķ�Ӧ��һ�����ȷ�Ӧ���ڷ�Ӧ������
A. ����ת�������� B. ��ѧ��ת��������
C. ����������������ڷ�Ӧ��������� D. ����������������ڷ�Ӧ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ˮ�ĵ���ƽ��������ͼ��ʾ���Իش��������⣺

��1��ͼ�����kw��Ĺ�ϵ��_____________��
��2������A�㵽D�㣬�ɲ��õĴ�ʩ�� ��
a.���� b.�������������� c.����������NH4Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������ʹ����ȷ���ǣ���
A. �ֳ��Թܸ��Թ��ڵ����ʼ���
B. ��ȼ�ŵľƾ���ȥ��ȼ��һյ�ƾ���
C. ����ƽ����ҩƷʱ����ֱ��������
D. �õιܵμ�Һ��ʱ�ι�Ӧ��ֱ�����������Ϸ��Ҳ��ܴ��������ڱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������ܴﵽʵ��Ŀ�ĵ���
A. ����ˮ���ռ�ͭ����Ũ���ᷴӦ������NO2
B. �ð�ˮ����NaCl��MgCl2��AlCl3��NH4Cl������Һ
C. ������KMnO4��Һ��֤����Ļ�ԭ��
D. �ñ���NaHCO3��Һ��ȥCl2�л��е�HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��1��105 Pa��298 K�����£�2 mol����ȼ������ˮ�������ų�484 kJ�����������Ȼ�ѧ����ʽ��ȷ����(�� ��)
A. H2O(g)===H2(g)��![]() O2(g)����H����242 kJ��mol��1
O2(g)����H����242 kJ��mol��1
B. 2H2(g)��O2(g)===2H2O(l)����H����484 kJ��mol��1
C. H2(g)��![]() O2(g)===H2O(g)����H����242 kJ��mol��1
O2(g)===H2O(g)����H����242 kJ��mol��1
D. 2H2(g)��O2(g)===2H2O(g)����H����484 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѹ���¿���ʹ����Һ�����ڴ˹����У�����˵����ȷ����
A�������еķ���������� B�������еķ��Ӽ����С
C�������еķ�������ı� D�������еķ�����Ŀ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ɳ����ԭ�����͵����� ��
A��Fe��SCN��3��Һ�м������KSCN����ɫ����
B���غ�ɫNO2��ѹ����ɫ�ȱ�����dz
C��SO2��������SO3�ķ�Ӧ��������Ҫʹ�ô���
D��H2��I2��HIƽ��������ѹ����ɫ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com