
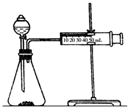
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
分析 实验一:(1)根据表中数据可知,硫酸的浓度相同,不同金属的规格相同,说明实验目的是探究反应物本身对反应速率的影响;影响反应速率的还有温度,所以应该使反应温度相同;
(2)根据图示装置及选取的试剂可知,实验目的是通过测定反应生成氢气快慢进行判断浓度对反应速率的影响;
实验二:(1)影响反应速率的因素除了浓度、温度外,催化剂也影响反应速率;
(2)根据反应方程式可知,反应产物中锰离子随着反应的进行,浓度变化较大,反应前加入硫酸锰,根据反应速率大小判断锰离子是否在该反应中起到催化作用.
解答 解:实验一:(1)根据表中的信息得出该同学的实验目的是研究反应物本身的性质对反应速率的关系对反应速率的影响;温度对化学反应速率的影响较大,故根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持温度相同,
故答案为:探究反应物本身的性质对反应速率的影响;温度相同;
(2)根据装置图可知,该实验目的是通过测量生成气体的量来研究浓度对反应速率的影响,用大小形状相同的Fe分别和0.5mol/L 及2mol/L的足量稀硫酸反应,通过测定和比较同时间内产生氢气的体积(或测定比较产生同体积氢气所需时间的长短),可以说明浓度对化学反应速率的影响,
故答案为:测定和比较同时间内产生氢气的体积(或测定比较产生同体积氢气所需时间的长短);
实验二:(1)对化学反应速率影响最快的是催化剂,故猜想还可能是催化剂的影响,可以从比较生成物Mn2+(过渡金属)与K+(主族金属)的区别中找到答案,即通常是过渡金属或其离子具有催化性,
故答案为:Mn2+的催化作用(或催化剂);
(2)反应方程式2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑中,浓度变化较大的为锰离子,所以选择做催化剂的试剂应该含有锰离子,而(C)中氯化锰中也含Mn2+,却不能选为催化剂,原因就在于其中的Cl-易被酸性高锰酸钾溶液氧化,故只有B正确,
故答案为:B.
点评 本题考查化学反应速率的影响因素,影响化学反应速率的外界条件有温度、浓度、压强、催化剂等,但外界条件只是影响反应速率,决定化学反应速率的是物质本身的性质,注意实验二第(2)小题不选C的原因,题目难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子核内有 10 个中子的氧原子:${\;}_{8}^{16}$O | |
| B. | 氢氧根离子的电子式: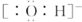 | |
| C. | 基态 Cr 的价电子排布式为:3d44s2 | |
| D. | 某元素原子的电子排布图: |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
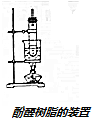 某课外活动小组结合一下材料制酚醛树脂,用苯酚和甲醛为原料,在酸或碱的催化作用下缩聚而成,苯酚过量,在酸性催化剂作用下,缩聚成线型结构的热塑性酚醛树脂,甲醛过量,在碱性催化剂作用下,缩聚成体型结构的热固性酚醛树脂设计实验如下:
某课外活动小组结合一下材料制酚醛树脂,用苯酚和甲醛为原料,在酸或碱的催化作用下缩聚而成,苯酚过量,在酸性催化剂作用下,缩聚成线型结构的热塑性酚醛树脂,甲醛过量,在碱性催化剂作用下,缩聚成体型结构的热固性酚醛树脂设计实验如下: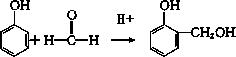
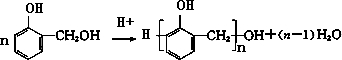
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)=c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
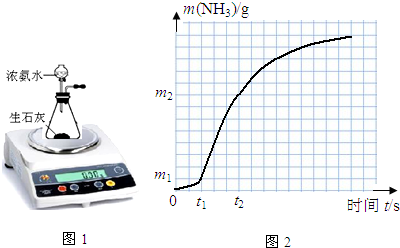
| 实验目的 | V(氨水)/mL | V(H2O)/mL | CaO的状态 | ||
| 实验1 | 实验1和实验2探究固体比表面积、实验1和实验3探究氨水浓度对v(NH3)的影响 | 30 | 粉末状 | ||
| 实验2 | 30 | ||||
| 实验3 | 40 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
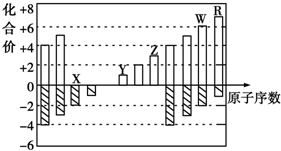
| A. | 离子半径:Y>Z>X | |
| B. | 气态氢化物的稳定性:R<W | |
| C. | WX3和水反应形成的化合物是离子化合物 | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
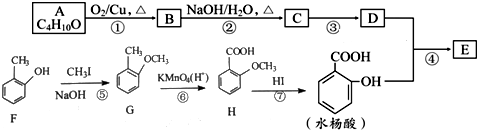
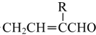
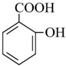 →
→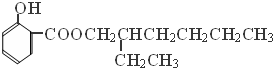 +H2O;
+H2O;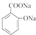
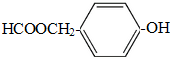 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.08 g | B. | 1.28 g | C. | 2.16 g | D. | 4.32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、NO2均为酸性氧化物 | B. | 石英、水玻璃均为纯净物 | ||
| C. | NaCl、BaSO4均为强电解质 | D. | 烧碱、纯碱均为碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com