
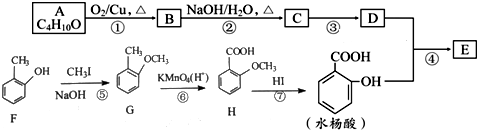
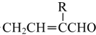
 →
→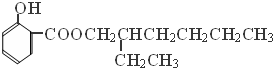 +H2O;
+H2O;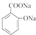
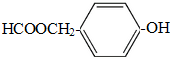 (写结构简式).
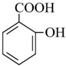
(写结构简式). 分析 A的分子式为C4H10O,分子中只含有1个甲基,可以发生催化氧化,则A的结构简式为CH3CH2CH2CH2OH,B的结构简式为CH3CH2CH2CHO,由题目信息可知C的结构简式为CH3CH2CH2CH=C(CH2CH3)CHO,D的相对分子质量为130,比C的相对分子质量大4,E为水杨酸酯,则D结构简式为CH3CH2CH2CH2CH(CH2CH3)CH2OH,C和氢气发生加成反应生成D,D和邻羟基苯甲酸发生酯化反应生成E,E结构简式为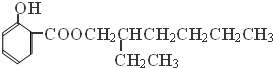 ,F发生取代反应生成G,G发生氧化反应生成H,H发生取代反应生成水杨酸,设计⑤和⑦的目的防止苯环上的酚羟其被氧化.
,F发生取代反应生成G,G发生氧化反应生成H,H发生取代反应生成水杨酸,设计⑤和⑦的目的防止苯环上的酚羟其被氧化.
解答 解:A的分子式为C4H10O,分子中只含有1个甲基,可以发生催化氧化,则A的结构简式为CH3CH2CH2CH2OH,B的结构简式为CH3CH2CH2CHO,由题目信息可知C的结构简式为CH3CH2CH2CH=C(CH2CH3)CHO,D的相对分子质量为130,比C的相对分子质量大4,E为水杨酸酯,则D结构简式为CH3CH2CH2CH2CH(CH2CH3)CH2OH,C和氢气发生加成反应生成D,D和邻羟基苯甲酸发生酯化反应生成E,E结构简式为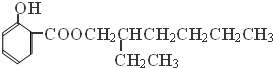 ,F发生取代反应生成G,G发生氧化反应生成H,H发生取代反应生成水杨酸,设计⑤和⑦的目的防止苯环上的酚羟其被氧化.
,F发生取代反应生成G,G发生氧化反应生成H,H发生取代反应生成水杨酸,设计⑤和⑦的目的防止苯环上的酚羟其被氧化.
(1)C的结构简式为CH3CH2CH2CH=C(CH2CH3)CHO,C中含氧官能团的名称为醛基,反应④的反应方程式为:CH3CH2CH2CH2CH(CH2CH3)CH2OH+ →
→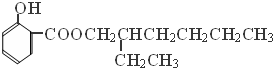 +H2O,
+H2O,
故答案为:醛基;CH3CH2CH2CH2CH(CH2CH3)CH2OH+ →
→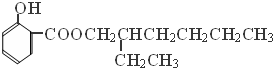 +H2O;
+H2O;
(2)在合成路线中,设计⑤和⑦的目的:防止苯环上的酚羟其被氧化,
故答案为:防止苯环上的酚羟其被氧化;
(3)X是B的最简单同系物,则X为HCHO,与足量银氨溶液反应的离子方程式:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32++2NH4++4Ag↓+6NH3+2H2O,
故答案为:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32++2NH4++4Ag↓+6NH3+2H2O;
(4)a.B为CH3CH2CH2CHO,有4种不同的氢,故a正确;
b.羧基能与碳酸氢钠反应,而酚羟基不能够与碳酸氢钠反应,故b错误;
c.D中含有醇羟基,能与金属钠反应,故c错误;
d.E中苯环能与氢气发生加成反应,1mol E与氢气加成,最多消耗3mol H2,故d错误.
故选:a;
(5)H有多种同分异构体,其中能同时满足下列条件:①能发生银镜反应,说明含有醛基,②能发生水解反应,说明含有酯基,为甲酸形成的酯基,③能与FeCl3溶液发生显色反应,说明含有酚羟基,含有2个侧链,除酚羟基外,另外的取代基为-CH2OOCH,有邻、间、对3种,含有3个取代基为-OH、-CH3、-OOCH,当-OH、-CH3有邻、间、对3种位置,对应的-OOCH分别有4种、4种、2种位置,故符合条件的同分异构体共有13种,其中有5种氢,且氢的个数比为1:1:2:2:2的为 ,
,
故答案为:13; .
.
点评 本题考查有机物的推断与合成,正确推断出A物质是解本题关键,结合题给信息进行分析解答,熟练掌握官能团的性质与转化,注意苯环上二元取代与三元取代同分异构体的判断.


科目:高中化学 来源: 题型:解答题
| 化学键 | N-H | N-N | O═O | N≡N | O-H |
| 键能 (kJ•mol-1) | 386 | 167 | 498 | 946 | 460 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
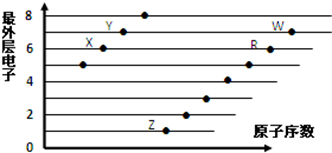
| A. | X和R在同一周期 | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的酸性:X>Y | |
| D. | X、Z形成的化合物中阴阳离子个数比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
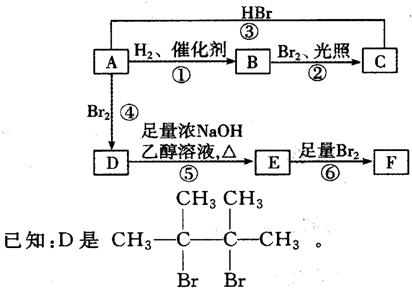
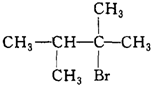 .
. ;;写出由E-F的化学方程式
;;写出由E-F的化学方程式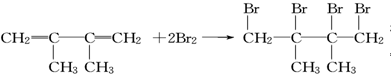 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R为ⅤA族元素 | |
| B. | R的氢化物的水溶液属于强酸 | |
| C. | 氧化剂与还原剂的物质的量之比为5:1 | |
| D. | R2在常温常压下一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
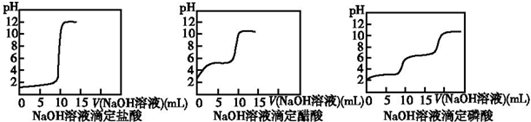
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com