
【题目】下列物质中,有顺反异构体的是( )
A. 1,2﹣二氯乙烯ClCH=CHCl
B. 1,1﹣二氯乙烯 Cl2C=CH2
C. 丙烯 CH3﹣CH=CH2
D. 苯乙烯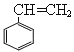
科目:高中化学 来源: 题型:
【题目】如图为一种天然产物,具有一定的除草功效。下列有关该化合物的说法错误的是

A. 分子中含有三种含氧官能团
B. 1mol该化合物最多能与4molNaOH反应
C. 既可以发生取代反应,又能够发生加成反应
D. 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)。
2Fe(s)+3CO2(g)。
(1)①该反应的平衡常数表达式为:K=___。
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为___。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:①___②___。
(3)明矾KAl(SO4)2·12H2O的水溶液呈___性(填”酸性、碱性、中性),溶液中各离子的浓度从大到小的顺序为____。
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:___,欲使上述体系中Al3+浓度增加,可加入的物质是____。
(5)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是____。
a. b.
b. c.
c. d.
d.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列结构示意图,判断下列说法中正确的是

A. 在NaCl晶体中,距Na+最近的多个Cl-构成正四面体
B. 在CaF2晶体中,Ca2+的配位数为4
C. 在金刚石晶体中,碳原子与碳碳键数之比为1:2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由下列方法制得高效饮用水处理剂高铁酸钠(Na2FeO4):Fe2O3+3Na2O2![]() 2Na2FeO4+Na2O,下列说法正确的是
2Na2FeO4+Na2O,下列说法正确的是
A.Fe粉与Al2O3可以通过铝热反应制Fe2O3
B.反应中Fe2O3是还原剂
C.3molNa2O2反应,有3mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
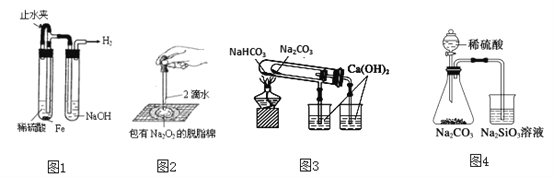
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图像如图所示。

(1)A、B、C、D四点中沉淀成分相同的是(写代号)_______________
(2)由图像可推出原溶液中一定含有的离子有:____________________
(3)若要检验可能存在的离子应采取的方法是______________________
(4)原溶液中含有的Fe3+和Al3+的物质的量之比为______________
(5)由图像计算使用的NaOH溶液的物质的量浓度是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力主要顺序为:i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;iv、其他。请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表:
n+m | 2 | ________ |
VSEPR理想模型 | ________ | 正四面体 |
价层电子对之间的理想键角 | ________ | 109°28′ |
(2)请用VSEPR模型解释CO2为直线型分子的原因_________________________________;
(3)H2O分子的立体构型为:___________________,请你预测水分子中∠H-O-H的大小范围并解释原因______________________________________________________________;
(4)SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测 SO2Cl2和SO2F2分子的立体构型:_____________________________, SO2Cl2分子中∠Cl-S-Cl________________(选填“<”、“>”或“=”)SO2F2分子中∠F-S-F。
(5)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
分子或 离子 | PbCl2 | XeF4 | SnCl62- | PF3Cl2 | HgCl42- | ClO4-- |
空间 构型 | _____ | _____ | _____ | _____ | _____ | _____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
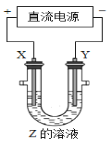
A. 氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
B. 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C. 电镀工业中,X是待镀金属,Y是镀层金属
D. 外加电流的阴极保护法中,X是待保护金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com