
【题目】下列有关实验的叙述正确的是( )
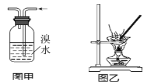
A.将Cl2通入KI淀粉溶液中,溶液先变蓝后褪色,说明Cl2有漂白性
B.图甲用于除去乙烯中的SO2
C.用图乙装置蒸干明矾溶液制KAl(SO4)2·12H2O晶体
D.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
科目:高中化学 来源: 题型:
【题目】现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )

A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积与反应时间的关系如图所示,则下列说法正确的是

A. 三种金属的活动性顺序为甲>乙>丙
B. 反应结束消耗硫酸的质量一定相同
C. 三种金属的相对原子质量是甲>乙>丙
D. 甲先反应完,乙最后反应完
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 键角:BF3>CH4>H2O>NH3
B. CO2、HClO、HCHO分子中一定既有σ键又有π 键
C. 已知二茂铁(Fe(C5H5)2)熔点是173 ℃(在100 ℃时开始升华),沸点是249℃,不溶于水,易溶于苯等非极性溶剂。在二茂铁结构中,C5H5 -与Fe2+之间是以离子键相结合
D. 在硅酸盐中,SiO44-四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图a,其中Si原子的杂化方式与b图中S8单质中S原子的杂化方式相同

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲用98%的浓H2SO4(ρ=1.84g/cm3)配制成500 mL 0.5 mol/L的稀H2SO4。
(1)填写下列操作步骤:
①所需浓H2SO4的体积为_________
②如果实验室有10 mL、20 mL、50 mL量筒,应选用____________mL量筒量取。
③将量取的浓H2SO4沿玻璃棒慢慢注入盛有约100 mL水的___里,并不断搅拌,目的是____。
④立即将上述溶液沿玻璃棒注入_______中,并用50 mL蒸馏水洗涤烧杯2~3次,并将洗涤液注入其中,并不时轻轻振荡。
⑤加水至距刻度_______处,改用______加水,使溶液的凹液面正好跟刻度相平。盖上瓶塞,上下颠倒数次,摇匀。
(2)请指出上述操作中一处明显错误:________。
(3)误差(填偏高、偏低、无影响)
操作②中量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将_________;若容量瓶中洗净后未干燥,残留少量水,则所配制的溶液浓度将_________;操作⑤中,若定容时,眼睛俯视,则所配制的溶液浓度将_________。
(4)想一想, 一定物质的量浓度溶液的配制
一般需要的仪器 _________;一般操作步骤:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() X表示原子:
X表示原子:
(1)中性原子的中子数N=______。
(2)AXn+共有x个电子,则该阳离子的中子数N=______。
(3)AXn-共有x个电子,则该阴离子的中子数N=______。
(4)12C16O2分子中的中子数N=________。
(5)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为Zn-聚苯胺二次电池的示意图,下列说法正确的是( )
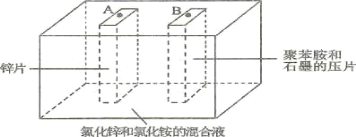
A.放电时,Zn片做负极,发生的电极方程式为Zn + 2e-=Zn2+
B.放电时,混合液中的Cl-向B移动
C.充电时,聚苯胺被氧化
D.充电时,A端接电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。查阅资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。②Cl2与KOH溶液在20 ℃以下反应生成KClO,在较高温度下则生成 KC1O3。
(1)用K2FeO4处理生活用水既可以消毒又可以沉降,其原理是K2FeO4与水反应生成Fe(OH)3 胶体,写出该反应的离子方程式:____________________________。
(2)实验室常利用氯气制备NaClO后与NaOH、Fe(NO3)3反应制备K2FeO4根据反应原理,仅根据下列仪器,请你组装合理、简洁的实验装置,所用的装置的接口连接顺序:___________________________。
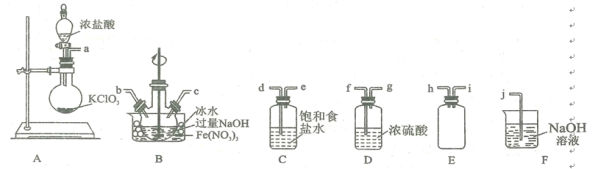
(3)写出装置A中发生的离子方程式: ______________________ 。
(4)三颈烧瓶用冰水浴的原因是 _________________,A处盛放KC1O3的仪器名称 ___________。
(5)将实验得到的Na2FeO4再加入饱和KOH溶液中,可析出紫黑色的K2FeO4粗晶体,其原因是________________________________________________________。
(6)高铁酸钾纯度检测:称取3.0 g制备的K2FeO4粗晶体溶于适量KOH溶液中,加入足量的KCrO2充分反应(此时Cr元素全部以CrO42- 形式存在),过滤,滤液在100 mL容量瓶中定容。取10.00 mL加人稀硫酸酸化,再用 0.10 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点(此时Cr元素全部以Cr3+形式存在),重复滴定3次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00 mL,则该K2FeO4样品的纯度为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com