
����Ŀ��ijͬѧ����98%��ŨH2SO4(��=1.84g/cm3)���Ƴ�500 mL 0.5 mol/L��ϡH2SO4��
(1)��д���в������裺
������ŨH2SO4�����Ϊ_________
�����ʵ������10 mL��20 mL��50 mL��Ͳ��Ӧѡ��____________mL��Ͳ��ȡ��
�۽���ȡ��ŨH2SO4�ز���������ע��ʢ��Լ100 mLˮ��___������Ͻ��裬Ŀ����____��
��������������Һ�ز�����ע��_______�У�����50 mL����ˮϴ���ձ�2��3�Σ�����ϴ��Һע�����У�����ʱ������
�ݼ�ˮ����̶�_______��������______��ˮ��ʹ��Һ�İ�Һ�����ø��̶���ƽ������ƿ�������µߵ����Σ�ҡ�ȡ�
(2)��ָ������������һ�����Դ���________��
(3)���(��ƫ�ߡ�ƫ�͡���Ӱ��)
����������ȡʱ������Ͳ���ɾ�����ˮϴ����ֱ����ȡ��������ҺŨ�Ƚ�_________��������ƿ��ϴ����δ�����������ˮ���������Ƶ���ҺŨ�Ƚ�_________���������У�������ʱ���۾����ӣ��������Ƶ���ҺŨ�Ƚ�_________��
(4)��һ��, һ�����ʵ���Ũ����Һ������
һ����Ҫ������ _________��һ������������_________��
���𰸡�13.6 mL 20 �ձ� ɢ�ȣ���ֹҺ��ɽ� 500mL����ƿ 1��2 cm ��ͷ�ι� �ڢܲ���Һδ��ȴ ƫ�� ��Ӱ�� ƫ�� ��ƽ(������)��ҩ�ס���Ͳ���ձ�������������ͷ�ιܡ�һ����������ƿ ���㡢����(����ȡ)���ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ��
��������
(1)�ٸ������ʵ���Ũ����������������ʽc=![]() ����98%�����ʵ���Ũ�ȣ�Ȼ��������Һ��ϡ��ǰ�����ʵ����ʵ������䣬������ҪŨ����������
����98%�����ʵ���Ũ�ȣ�Ȼ��������Һ��ϡ��ǰ�����ʵ����ʵ������䣬������ҪŨ����������
��ѡ����Ͳ���ʱԭ���� ������������ݴ�ѡ������Ͳ���
��ϡ��Ũ��Һ���������ձ���Ũ����ϡ�ͷ��ȣ��ò����������Ŀ����ʹ��Ͼ��ȣ�ʹ����Ѹ����ɢ��
����Һ�ǽ�ϡ�Ͳ���ȴ�õ���Һת�Ƶ�����ƿ�У�
�ݶ���ʱ��ֱ�Ӽ�������ˮ����̶� 1��2 cm�������ý�ͷ�ιܶ��ݣ�
(2)Ũ����ϡ�ͷ��ȣ��ȵ���Һ���ƫ��
(3)����c=![]() ��������ʵ����ʵ���n����Һ�����V�ı仯����ʵ����
��������ʵ����ʵ���n����Һ�����V�ı仯����ʵ����
(4)��������һ�����һ�����ʵ���Ũ�ȵ���Һ����ȷ��ʹ�õ�������
(1)��98%��Ũ��������ʵ���Ũ��Ϊc=![]() mol/L=18.4 mol/L��������Һ��ϡ��ǰ�����ʵ����ʵ������䣬��֪����500 mL 0.5 mol/L��ϡH2SO4��ҪŨ��������V(H2SO4)=
mol/L=18.4 mol/L��������Һ��ϡ��ǰ�����ʵ����ʵ������䣬��֪����500 mL 0.5 mol/L��ϡH2SO4��ҪŨ��������V(H2SO4)= ![]() =13.6 mL��
=13.6 mL��
����ҪŨ����������13.6 mL���������������ԭ��Ӧѡ�ù��Ϊ20 mL����Ͳ��
��ϡ��Ũ����Ӧ�����ձ��н��У�����ȡ��ŨH2SO4�ز���������ע��ʢ��Լ100 mLˮ���ձ��У�����Ũ��������ˮ��ų��������ȣ�Ϊ��ɢ�ȣ���ֹҺ��ɽ�����Ҫ�ò��������Ͻ��裻
������500 mL 0.5 mol/L��ϡH2SO4��Ҫѡ�ù��Ϊ500 mL����ƿ����Ӧ�ý�ϡ�Ͳ���ȴ�õ���Һת�Ƶ�500 mL����ƿ�У�����50 mL����ˮϴ���ձ�2��3�Σ�����ϴ��Һע�����У�����ʱ������
�ݶ��ݵIJ����ǿ�ʼֱ��������ƿ�м�ˮ����ˮ����̶� 1��2 cm�������ý�ͷ�ι���μ����ˮ��ʹ��Һ�İ�Һ�����ø��̶���ƽ������ƿ�������µߵ����Σ�ҡ�ȣ�
(2)Ũ����ϡ�ͷ��ȣ�����ƿʹ�õ��¶������£��ȵ���Һ��Ӱ��������Һ����������ܽ��ȵ���Һֱ��ת��������ƿ�У�Ӧ��ϡ�ͺ����Һ��ȴ�����£�Ȼ���ٽ�����Һ����������������һ�����Դ����ǵڢܲ���û����ȴ��
(3)����������ȡʱ������Ͳ���ɾ�����ˮϴ����ֱ����ȡ�ᵼ��Ũ���ᱻϡ�ͣ���ȡ��Ũ��������ʵ���ƫС��������ҺŨ�Ƚ�ƫ�ͣ�������ƿδ���T����������Һ�����ڲ�Ӱ�����ʵ����ʵ�������Һ����������Զ�������Һ��Ũ����Ӱ�죻�������У�������ʱ���۾����ӣ��ᵼ����Һ���ƫС���������ʵ����ʵ������䣬��˻ᵼ�������Ƶ���ҺŨ��ƫ�ߣ�
(4)����һ�������һ�����ʵ���Ũ����Һ�IJ����У����㡢����(����ȡ)���ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�����ȡʱҪʹ����Ͳ�����ܽ�����ʱҪʹ���ձ���������������ҺʱҪʹ��һ���������ƿ�����������������ʱҪʹ�ý�ͷ�ιܣ����Ҫʹ��Һ����������һ�����ʵ���Ũ�ȵ���Һʱʹ�õ������У���Ͳ���ձ�������������ͷ�ιܡ�һ����������ƿ��������Ϊ���壬����Ҫʹ��������ƽ(������)��ҩ�ף���һ������£�����һ�����ʵ���Ũ����Һʹ�õ������У�������ƽ(������)��ҩ�ס���Ͳ���ձ�������������ͷ�ιܡ�һ����������ƿ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��ԭ�ӵĽṹʾ��ͼΪ_____��
(2)�����ӵ���ʽΪ_____��
(3)0�棬1atmʱ��CO2������Ħ�����ԼΪ_____L/mol��
(4)1����ͨˮ���ӵ�������Լ��_____g��
(5)�����£�ˮ��Ħ�����ԼΪ_____cm3/mol��
(6)��֪n��12Cԭ�ӵ�������a�ˣ���m��32Sԭ�ӵ�����Լ��_____��
(7)��ⱥ��ʳ��ˮ�ķ���ʽΪ_____����ҵ��Ư�۵ķ���ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50 mLϡH2SO4��ϡHNO3�Ļ����Һ���������ۣ�����������۵����������������������״����֮��Ĺ�ϵ��ͼ��ʾ����ÿһ��ֻ��Ӧһ����Ӧ������˵����ȷ���ǣ� ��
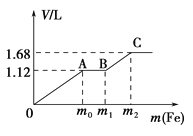
A. ��ʼʱ����������ΪH2
B. AB�η����ķ�ӦΪ�û���Ӧ
C. �μӷ�Ӧ���۵�������m2=5.6 g
D. ���û����Һ��c��HNO3��=0.5 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���ͬѧ�����ϲ�ѯ����ʱ��֪�������CO2��Na2O2���ܷ�Ӧ��ֻ����ˮ���������¶��߲��ܷ�����Ӧ�������������ͼ��ʾʵ��װ�ã�������֤�������ۡ�
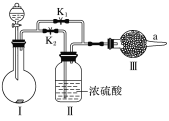
(1)װ�â��е��Լ�����������________(����ĸ)��
a��ϡ���� b��ϡ����
c��С�մ� d��ʯ��ʯ
(2)ʵ��ʱ����ͬѧ��Ϊ�ر�K1����K2��ͨ���۲�________�жϴ�ʱ�����Ƿ����˻�ѧ��Ӧ��
(3)��ͬѧ��Ϊ���Էֱ����ȹر�K1����K2���ٹر�K2����K1���ķ�ʽ���в���������a���ռ��������壬Ȼ���ô����ǵ�ľ�������ռ��������壬�����������������ľ����û�и�ȼ��
�ٱ�ͬѧ�����۲�����������ڢ��װһ��ʢ�м�ʯ�ҵĸ���ܣ�Ŀ����________________
�ڶ�ͬѧ��Ϊ��ʹ���ɱ�ͬѧ�Ľ��������չ۲쵽ľ����ȼ��Ҳ����֤��CO2�����˷�Ӧ��ԭ����________________________
(4)Ϊ��һ���ﵽʵ��Ŀ�ģ�Ӧ�����ʵ������ǣ�ȡ���շ�Ӧ��������ù��壬____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A.��5.85 g NaCl��������100 mLˮ�У��Ƶ�0.1 mol/L��NaCl��Һ
B.��25 g��ˮCuSO4����ˮ�Ƴ�100 mL��Һ����Ũ��Ϊ1 mol/L
C.��w g a����NaCl��Һ������![]() gˮ���õ�2a����NaCl��Һ
gˮ���õ�2a����NaCl��Һ
D.��1���c1 mol/L��������ˮϡ��Ϊ5�����ϡ��Һ��Ũ��Ϊ0.2c1 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ���������ȷ���ǣ� ��
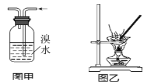
A.��Cl2ͨ��KI������Һ�У���Һ�ȱ�������ɫ��˵��Cl2��Ư����
B.ͼ�����ڳ�ȥ��ϩ�е�SO2
C.��ͼ��װ������������Һ��KAl(SO4)2��12H2O����
D.�ζ��ӽ��յ�ʱ���ζ��ܵļ�����ԽӴ���ƿ�ڱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������װ�ô�����KMnO4�ķ�Һ��ʹMnԪ��ת��ΪMnO2�������Ӷ������ؽ�����Ⱦ������˵���������
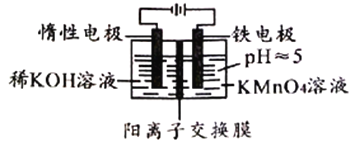
A. MnO4-������ȫ��ʵ�����ʱ�����ܻ����ɳ���
B. �Ҳ������Fe2+����MnO4-�����ӷ���ʽΪ��7H2O+3Fe2++MnO4-=3Fe(OH)3��+MnO2��+5H+
C. ����·��ת��6mole-ʱ�����Բ���87gMnO2����
D. Ϊ�������Ҳ���Һ�ĵ����Կ��Լ�ϡ�������ǿ���Ի���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������װ��(�̶����г�װ�á���������������)�����йذ�����ȡ��ʵ��̽����
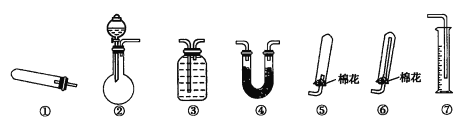
�ش���������:
��1������װ�â���ȡNH3,�䷴Ӧ�Ļ�ѧ����ʽΪ__________;��Ҫ�ⶨ���ɵ�NH3�����,�����ѡ���װ����__________(��װ�����),װ������ʢ�Լ�Ӧ���е�������__________��
��2������װ�â���ȡ���ռ������NH3,��ƿ��װ���Լ���__________,��Һ©����װ���Լ���__________,�ռ�װ��Ӧѡ��__________(��װ�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ����ᾧˮ�����ⶨ��ʵ������У��������������δ�漰����
A.  B.
B. 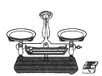 C.
C.  D.
D. 
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com