
【题目】(1)钙原子的结构示意图为_____。
(2)氧离子电子式为_____。
(3)0℃,1atm时,CO2的气体摩尔体积约为_____L/mol。
(4)1个普通水分子的质量大约是_____g。
(5)常温下,水的摩尔体积约为_____cm3/mol。
(6)已知n个12C原子的质量是a克,则m个32S原子的质量约是_____。
(7)电解饱和食盐水的方程式为_____;工业制漂白粉的方程式为_____。
【答案】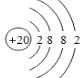
![]() 22.4 2.99×10-23 18
22.4 2.99×10-23 18 ![]() g 2NaCl+2H2O
g 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2NaOH+H2↑+Cl2↑ 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
(1)根据原子核外电子排布书写原子结构示意图;
(2)O原子获得2个电子变为O2-;
(3)在标准状况下的气体摩尔体积是22.4L/mol;
(4)1molH2O质量是18g,其中含有H2O分子数目为6.02×1023计算;
(5)常温下,水的密度约是1g/cm3,水的摩尔质量为18g/mol,可计算出18mL水的物质的量是1mol,进而可得1molH2O的体积;
(6)先计算1个C原子的质量,然后结合相对原子质量计算1个S原子的质量,载计算m个S原子的质量;
(7)电解饱和食盐水反应产生NaOH、Cl2、H2;工业上用氯气与石灰乳反应制漂白粉。
(1)Ca原子核外电子数为20,有4个电子层,由里到外各层容纳电子数分别为2、8、8、2,原子结构示意图为: ;
;
(2)O原子最外层有6个电子,获得2个电子变为O2-,达到最外层8个电子的稳定结构,所以氧离子电子式为:![]() ;
;
(3)在标准状况下的气体摩尔体积是222.4L/mol;
(4)1mol水的质量为18g,1mol水含有约6.02×1023个水分子,则1个水分子质量为:18g÷6.02×1023≈2.99×10﹣23g;
(5)常温下,水的密度约是1g/cm3,水的摩尔质量为18g/mol,则1molH2O的体积是18mL,所以水的摩尔体积约是:18mL÷1mol=18mL/mol=18cm3/mol;
(6)1个12C原子的质量为![]() g,则1个32S原子质量为
g,则1个32S原子质量为![]() g×
g×![]() ,所以m个32S原子的质量约是为
,所以m个32S原子的质量约是为![]() g×
g×![]() ×m=
×m=![]() g;
g;
(7)电解饱和氯化钠溶液生成氢氧化钠、氯气与水,反应方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;氯气与石灰乳反应生成氯化钙、次氯酸钙与水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
2NaOH+H2↑+Cl2↑;氯气与石灰乳反应生成氯化钙、次氯酸钙与水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.根据下表左边的“实验操作”,从右边的“实验现象”中选择正确的字母代号,填入对应“答案”的空格中。
实验操作 | 答案 | 实验现象 |
(1)让一束光线通过Fe(OH)3胶体 | ______ | A.呈蓝色 B.生成白色胶状沉淀 C.呈现光亮“通路” D.产生红褐色沉淀 |
(2)向盛有FeCl3溶液的试管中加入NaOH溶液 | ______ | |
(3)向Al2(SO4)3溶液中滴加氨水 | ______ | |
(4)向土豆片上滴加碘水 | ______ |
Ⅱ.某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案。
(1)提出假设:Na2CO3或NaHCO3加热分解时可能有CO2生成。
(2)设计实验:①利用下图装置分别对一定量的Na2CO3和NaHCO3进行加热;②为了检验CO2的生成,试管B中应加入的物质是_____________。
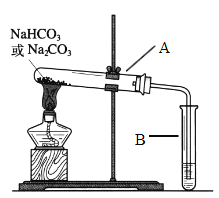
(3)现象与结论:同学们发现只有在加热NaHCO3时,试管B中才有气泡产生且有_______________沉淀生成(填沉淀的颜色),说明Na2CO3和NaHCO3的热稳定性是:Na2CO3_______ NaHCO3(填“>”或“<”)。
(4)某同学在探究NaHCO3的热稳定性时,称取了8.4gNaHCO3,充分加热,请你计算理论上可产生CO2气体的体积为__________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有:c(Na+)+c(OH-)=c(H+)+ c(HClO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜广泛应用于有机合成、石油、油脂、染料等工业。以某种铜矿粉(含Cu2S、CuS及FeS等)为原料制取CuCl的工艺流程如下:
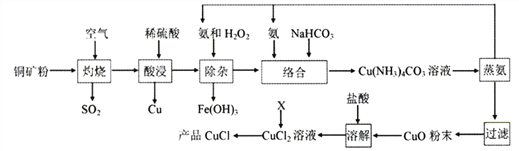
已知:①CuS、Cu2S、FeS灼烧固体产物为Cu2O、FeO;
②Ksp(CuCl)=2×10-7,2Cu+=Cu+Cu2+的平衡常数K1=1×106
回答下列问题:
(1)“灼烧”时,被还原的元素有____________(填元素符号)。
(2)“酸浸”所需H2SO4是用等体积的98%H2SO4和水混合而成。实验室配制该硫酸溶液所需的玻璃仪器除玻璃棒、胶头滴管外,还有_______。“酸浸”时硫酸不宜过多的原因是__________________。
(3)“除杂”的总反应方程式是_____________________。
(4)“络合”反应中的NH3与NaHCO3理论比值是____________________。
(5)加热“蒸氨”在减压条件下进行的原因是________________。
(6)X可以充分利用流程中的产物,若X是SO2时,通入CuCl2溶液中反应的离子方程式是________________;若X是Cu时,反应Cu+Cu2++2Cl-=2CuCl的平衡常数K2=_________。
(7)以铜为阳极电解NaCl溶液也可得到CuCl,写出阳极电极反应式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是重要的工业元素。
(1)铁元素位于周期表中的___________区,Fe的外围电子排布的轨道表示式为_____,Fe的7个能级中能量最高的是__________________。
(2)(NH4)2Fe(SO4)2·6H2O俗称摩尔盐,其中H2O的VSEPR模型名称为______________。写出一种与SO42-互为等电子体的分子的化学式__________________。
(3)金属Fe具有导电性,温度越高其导电性越____________,其原因是__________________。
(4)ZnCl2浓溶液常用于除去Fe表面的氧化物,反应可得[Zn(OH)2Cl2]2-溶液。[Zn(OH)2Cl2]2-中肯定不存在的微粒间作用力有_________________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
画出溶液中[Zn(OH)2Cl2]2-的结构式,并表示出配位键____________________。
(5)某种磁性氮化铁的结构如图所示 ,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为
,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为![]() ,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下CH4、H2S、NH3均为气体,分别有①11.2L H2S②16g CH4③1.204×1024个NH3分子,下列物理量大小比较正确的是( )
A. 体积:②>③>①
B. 密度:③>②>①
C. 质量:③>②>①
D. 原子总数:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。B、C中均加有10mL 1mol/L的NaBr溶液。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.打开活塞b,将少量液体放入D中,取下试管并振荡。
(1)验证氯气的氧化性强于碘的实验现象是________________________________________。
(2)B中溶液发生反应的化学方程式是____________________________________________。
(3)过程Ⅳ中出现的现象是________,由此可证明氧化性较强的是________(填“Br2”或“I2”)。
(4)设计过程Ⅲ的目的是__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com