
【题目】已知A、B都为短周期元素,且甲、乙、丙常温下都为气体(如图所示)。2 mol甲分子反应生成1 mol 丙和3 mol乙,下列对此判断不正确的是( )

A. 1个乙分子中含有2个A原子
B. 甲的摩尔质量为17 g·mol-1
C. 同温同压下,生成丙和乙的体积比为1∶3
D. 标准状况下,11.2 L甲溶于500 mL水中,所得溶液中甲的物质的量浓度为1 mol·L-1
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式,并回答相关问题:
(1)草酸使酸性高锰酸钾溶液褪色的离子方程式为____________________________________;紫色溶液的褪色速率先慢后快,然后又变慢,褪色速率加快的原因是__________________________________。
(2)0.1 mol/L硫代硫酸钠与0.1mol/L稀硫酸反应的离子方程式为_____________________________,实验现象为_______________________________。
(3)①H2O2在常温下分解比较慢,但在MnO2催化下可以剧烈分解,并且剧烈放热。写出反应的化学方程式:________________________________。
②实验室常用过氧化钡与稀硫酸反应制取H2O2,写出反应的化学方程式:_______________________。
③Na2O2与水的反应历程实际上是Na2O2先和水反应生成H2O2,然后H2O2再分解产生氧气。②和③的实验说明H2O2保存在酸性溶液中比在碱性溶液中_________(填“稳定”“不稳定”或“一样稳定”),说明_________(填离子符号)能够催化H2O2分解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+===Cu2++H2↑,则下列关于该装置的说法正确的是( )
A. 该装置可能是原电池,也可能是电解池
B. 该装置只能是原电池,且电解质溶液为HNO3溶液
C. 该装置只能是电解池,且金属铜为该电解池的阳极
D. 该装置只能是原电池,电解质溶液不可以是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题:
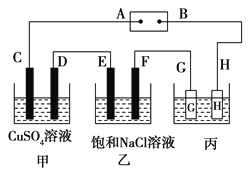
(1)电极A是__________________(填“正极”或“负极”)。
(2)甲装置中电解反应的总化学方程式是_______________。
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH=__________________。
(4)欲用丙装置给铜镀银。G应该是___(填“银”或“铜”),电镀液的主要成分是______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 随着核电荷数增加,碱金属单质的密度逐渐增大
B. 随着核电荷数增加,卤素单质的熔沸点逐渐降低
C. 随着核电荷数的增加,碱金属单质与水反应的剧烈程度增大
D. 随着核电荷数增加,碱金属离子的氧化性逐渐增强,卤素离子的还原性逐渐减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com