
【题目】写出下列反应的离子方程式,并回答相关问题:
(1)草酸使酸性高锰酸钾溶液褪色的离子方程式为____________________________________;紫色溶液的褪色速率先慢后快,然后又变慢,褪色速率加快的原因是__________________________________。
(2)0.1 mol/L硫代硫酸钠与0.1mol/L稀硫酸反应的离子方程式为_____________________________,实验现象为_______________________________。
(3)①H2O2在常温下分解比较慢,但在MnO2催化下可以剧烈分解,并且剧烈放热。写出反应的化学方程式:________________________________。
②实验室常用过氧化钡与稀硫酸反应制取H2O2,写出反应的化学方程式:_______________________。
③Na2O2与水的反应历程实际上是Na2O2先和水反应生成H2O2,然后H2O2再分解产生氧气。②和③的实验说明H2O2保存在酸性溶液中比在碱性溶液中_________(填“稳定”“不稳定”或“一样稳定”),说明_________(填离子符号)能够催化H2O2分解。
【答案】 5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O 生成的Mn2+对上述反应有催化作用 S2O32-+2H+ =S↓+SO2↑+H2O 产生淡黄色或乳白色沉淀 2H2O2![]() 2H2O+O2↑ BaO2+H2SO4 (稀)==BaSO4↓+ H2O2 稳定 OH-
2H2O+O2↑ BaO2+H2SO4 (稀)==BaSO4↓+ H2O2 稳定 OH-
【解析】(1)高锰酸钾溶液具有氧化性,草酸使酸性高锰酸钾溶液褪色的离子方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;生成的Mn2+对上述反应有催化作用,使得紫色溶液的褪色速率加快,故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;生成的Mn2+对上述反应有催化作用;
(2)0.1 mol/L硫代硫酸钠与0.1mol/L稀硫酸反应生成硫和二氧化硫,反应的离子方程式为S2O32-+2H+ =S↓+SO2↑+H2O,现象为产生淡黄色或乳白色沉淀,故答案为:S2O32-+2H+ =S↓+SO2↑+H2O;产生淡黄色或乳白色沉淀;
(3)①H2O2在MnO2催化下可以剧烈分解的化学方程式为2H2O2![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
②实验室常用过氧化钡与稀硫酸反应制取H2O2,反应的化学方程式为BaO2+H2SO4 (稀)==BaSO4↓+ H2O2,故答案为:BaO2+H2SO4 (稀)==BaSO4↓+ H2O2;
③Na2O2与水的反应历程实际上是Na2O2先和水反应生成H2O2和氢氧化钠,然后H2O2再分解产生氧气,说明氢氧化钠能够使过氧化氢分解,因此②和③的实验说明H2O2在酸性溶液中比在碱性溶液中稳定,故答案为:稳定;OH-。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室制备硅酸的反应为Na2SiO3+2HCl=2NaCl+H2SiO3↓,该反应属于
A. 化合反应 B. 分解反应 C. 复分解反应 D. 置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。N2H4 (1)与N2O4(g)生成4 mol H2O(g)时放出热量1077 kJ,写出其热反应方程式:_____________________________________。
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2 (g)将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2 (g)将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
①由图推测该反应ΔH_______0(填“>”或“<”),理由为__________________________。
②图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,列式计算该温度下反应的平衡常数Kp =____________。(保留一位小数,并带单位。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
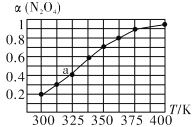
③在一定条件下,该反应N2O4、NO2两者的消耗速率与自身压强间存在关系:v消耗(N2O4)=k1· P(N2O4),v消耗(NO2)=k2·P2(NO2),其中k1、k2是与反应温度有关的速率常数。则一定温度下,k1、k2与平衡常数Kp的关系是k1=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是
A. 钠与水反应:2Na+2H2O=2Na+ + 2OH- +H2↑
B. 电解饱和食盐水获取碱和氯气:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. 向碳酸氢铵溶液中加入过量石灰水:Ca2+ +HCO3- +OH-=CaCO3 ↓+H2O
D. 向氢氧化钡溶液中加入稀硫酸:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料(已知两种原料中均不含有单质杂质)制备高纯度硫酸锰的工艺流程如图所示。
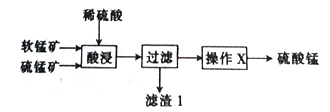
(1)已知滤渣1中含有一种非金属单质,该非金属单质的化学式为_____________________。
(2)已知二氧化锰与硫化锰的物质的量之比对酸浸时的浸出率有影响,相关实验数据如下表所示。当二氧化锰与硫化锰的物质的量之比为______________时,为最优反应配比。
号 | 二氧化锰与硫化锰的物质的量之比 | 浸出液的pH | 浸出率% |
1 | 1.25:1 | 2.5 | 95.30 |
2 | 1.75:1 | 2.5 | 97.11 |
3 | 2.25:1 | 2.5 | 99.00 |
4 | 2.5:1 | 2.5 | 98.40 |
(3)操作X为蒸发浓缩、______________、过滤,洗涤、烘干,在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,其主要目的是_________。
(4)现有10t锰矿,其中MnO2和MnS的含量均为29%,若流程中Mn的损耗率为10%,则最终制得硫酸锰(MnSO4·H2O)_________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《本草纲目》记载:“生熟铜皆有青,即是铜之精华,大者即空绿,以次空青也。铜青则是铜器上绿色者,淘洗用之。”这里的”铜青”是指
A. CuO B. Cu2O C. Cu D. Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B都为短周期元素,且甲、乙、丙常温下都为气体(如图所示)。2 mol甲分子反应生成1 mol 丙和3 mol乙,下列对此判断不正确的是( )

A. 1个乙分子中含有2个A原子
B. 甲的摩尔质量为17 g·mol-1
C. 同温同压下,生成丙和乙的体积比为1∶3
D. 标准状况下,11.2 L甲溶于500 mL水中,所得溶液中甲的物质的量浓度为1 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com