
【题目】以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料(已知两种原料中均不含有单质杂质)制备高纯度硫酸锰的工艺流程如图所示。
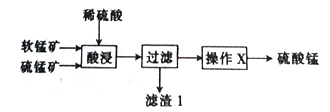
(1)已知滤渣1中含有一种非金属单质,该非金属单质的化学式为_____________________。
(2)已知二氧化锰与硫化锰的物质的量之比对酸浸时的浸出率有影响,相关实验数据如下表所示。当二氧化锰与硫化锰的物质的量之比为______________时,为最优反应配比。
号 | 二氧化锰与硫化锰的物质的量之比 | 浸出液的pH | 浸出率% |
1 | 1.25:1 | 2.5 | 95.30 |
2 | 1.75:1 | 2.5 | 97.11 |
3 | 2.25:1 | 2.5 | 99.00 |
4 | 2.5:1 | 2.5 | 98.40 |
(3)操作X为蒸发浓缩、______________、过滤,洗涤、烘干,在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,其主要目的是_________。
(4)现有10t锰矿,其中MnO2和MnS的含量均为29%,若流程中Mn的损耗率为10%,则最终制得硫酸锰(MnSO4·H2O)_________t。
【答案】 S 2.25:1 冷却结晶 减少MnSO4·H2O的溶解损失,并加快MnSO4·H2O的干燥 10.14
【解析】(1)MnO2将MnS氧化,滤渣1中含有一种非金属单质,该非金属单质的化学式为S;(2)二氧化锰与硫化锰的物质的量之比2.25:1时,浸出率最高;(3)操作X为蒸发浓缩、冷却结晶、过滤,洗涤、烘干,在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,其主要目的是:减少MnSO4·H2O的溶解损失,并加快MnSO4·H2O的干燥;
(4)MnO2+MnS+4H+=2Mn2++S+2H2O,得关系式:
MnO2~MnS~2(MnSO4·H2O)
87 87 338
10t×29%×(1-10%) m
解得:m=10.14


科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 将饱和氯化铁溶液逐滴加入煮沸的蒸馏水中制备氢氧化铁胶体:Fe3+ + 3H2O ![]() Fe(OH)3↓+ 3H+
Fe(OH)3↓+ 3H+
B. 向FeBr2溶液中通入过量Cl2:2Fe2+ + 2Br- + 2Cl2 = 2Fe3++ Br2 + 4Cl-
C. 将NaHCO3溶液与过量的Ca(OH)2溶液混合:HCO3- + OH-+ Ca2+ = CaCO3↓+ H2O
D. 用KIO3氧化酸性溶液中的KI:5I- + IO3- + 3H2O = 3I2 + 6OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属材料的说法中,不正确的是( )
A. 钢是用量最大、用途最广的合金
B. 合金只含金属元素
C. 铝制饮料罐应回收利用
D. 青铜是铜合金中的一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有相同质子数和电子数的两种微粒之间的关系不正确的是:
A. 它们可能是同位素 B. 可能是不同的分子
C. 可能是不同的离子 D. 可能是一种分子和一种离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式,并回答相关问题:
(1)草酸使酸性高锰酸钾溶液褪色的离子方程式为____________________________________;紫色溶液的褪色速率先慢后快,然后又变慢,褪色速率加快的原因是__________________________________。
(2)0.1 mol/L硫代硫酸钠与0.1mol/L稀硫酸反应的离子方程式为_____________________________,实验现象为_______________________________。
(3)①H2O2在常温下分解比较慢,但在MnO2催化下可以剧烈分解,并且剧烈放热。写出反应的化学方程式:________________________________。
②实验室常用过氧化钡与稀硫酸反应制取H2O2,写出反应的化学方程式:_______________________。
③Na2O2与水的反应历程实际上是Na2O2先和水反应生成H2O2,然后H2O2再分解产生氧气。②和③的实验说明H2O2保存在酸性溶液中比在碱性溶液中_________(填“稳定”“不稳定”或“一样稳定”),说明_________(填离子符号)能够催化H2O2分解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B、C、D、E之间的转化关系如图所示。

已知:
回答下列问题:
(l)A中含有的官能团名称为_________。
(2)由C 生成D 的反应类型为________。
(3)X 的结构简式为_________。
(4)由D 生成E 的化学方程式为_________。
(5)F是D的同分异构体,符合下列条件的F 的结构共有________种(不考虑立体异构)。
①能与NaHCO3溶液发生反应 ②能与FeCl3溶液发生显色反应 ③苯环上只有2个取代基
(6)写出以环戊烷和2-丁烯为原料(其他无机试剂任选)制备化合物![]() 的合成路线_______。
的合成路线_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+===Cu2++H2↑,则下列关于该装置的说法正确的是( )
A. 该装置可能是原电池,也可能是电解池
B. 该装置只能是原电池,且电解质溶液为HNO3溶液
C. 该装置只能是电解池,且金属铜为该电解池的阳极
D. 该装置只能是原电池,电解质溶液不可以是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了便于理解和记忆,小丽同学总结了碱的化学性质如图,请完成下列问题.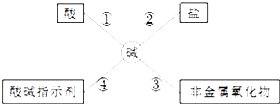
(1)氢氧化钠具有强烈的 , 使用时必须十分小心,实验时最好戴防护眼镜.
(2)为了验证④,小丽将紫色石蕊溶液分别滴入氢氧化钠溶液和澄清石灰水中,溶液变成蓝色,原因是它们在水溶液中能电离出 .
(3)依据反应③什么氢氧化钠必须密封保存否则在空气中要变质;反应的化学方程式为 . 要检验该氢氧化钠溶液已变质,可以选用的试剂是 . (写出化学式)
(4)依据反应②,氢氧化钙溶液能与下列物质反应的是(填序号).
A.稀硫酸
B.氯化钠溶液
C.硫酸铜溶液
D.碳酸钠溶液.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com