
【题目】近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx等挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g) ![]() CO2(g)+2H2O(g)+N2 (g) △H=_____kJ·mol-1;该反应在_____(高温,低温,任何温度)下可自发进行
CO2(g)+2H2O(g)+N2 (g) △H=_____kJ·mol-1;该反应在_____(高温,低温,任何温度)下可自发进行
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0,在一定温度下的定容容器中,能说明上述平衡达到平衡状态的是:_______________。
2SO3(g) △H< 0,在一定温度下的定容容器中,能说明上述平衡达到平衡状态的是:_______________。
A. 混合气体的密度不再发生变化 B.混合气体的平均摩尔质量不再发生变化
C. v(SO2):v(O2):v(SO3)=2:1:2 D.混合气体的总物质的量不再发生变化
(3)若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如下图所示。

①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)_____v A(逆) (填“>"、“<”或“ = ”)。
③图中B点的平衡常数Kp=______。(Kp=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压物质的量分数)
(4)为了清除NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理。现有由a mol NO、b molNO2、c molN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为____________。
【答案】-875.3 任何温度下 BD 45% > 24300(MPa)-1 (a+b+2c)/V mol·L-1
【解析】
根据盖斯定律分析反应热,根据平衡状态的判断依据分析,根据平衡的三段式计算平衡时物质的量,进而计算平衡常数和转化率等,根据反应过程中元素守恒分析氮原子和钠原子的关系,进而计算氢氧化钠的物质的量。
(1). 根据盖斯定律分析,①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1;②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1;③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1,有①-②-③×2得热化学方程式为:CH4(g)+2NO2(g)
2NO2(g) △H=+67.0 kJ·mol-1;③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1,有①-②-③×2得热化学方程式为:CH4(g)+2NO2(g) ![]() CO2(g)+2H2O(g)+N2 (g) △H=(-890.3-67.0+41×2) kJ·mol-1=-875.3kJ·mol-1;该反应为放热的熵增反应,所以该反应在任何温度下都能自发进行;
CO2(g)+2H2O(g)+N2 (g) △H=(-890.3-67.0+41×2) kJ·mol-1=-875.3kJ·mol-1;该反应为放热的熵增反应,所以该反应在任何温度下都能自发进行;
(2) A.因为该反应是在一定的容器中进行,容器的体积不变,混合气体的总质量不变,所以混合气体的密度始终不变,所以密度不再发生变化不能说明是平衡状态,故错误;B.混合气体的平均摩尔质量是混合气体的总质量和总物质的量的比值,因为总质量始终不变,但气体总物质的量随着反应的进行而改变,所以当平均摩尔质量不再发生变化时说明气体总物质的量不变,说明反应达到平衡,故正确;C. v(SO2):v(O2):v(SO3)=2:1:2没有说明反应速率的方向,不能确定是否为平衡状态,故错误;D.混合气体的总物质的量不再发生变化可以说明反应达到平衡,故正确。故选BD;
(3) ①设起始二氧化硫的物质的量为2mol,氧气的物质的量为1mol
2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
起始物质的量 2 1 0
改变物质的量2x x 2x
平衡物质的量 2-2x 1-x 2x
则有(2-2x+1-x+2x)/(2+1)=0.085/0.1 解x=0.45,二氧化硫的转化率为![]() ×100%= 45%
×100%= 45%
②A点未到平衡,正反应速率小于逆反应速率,C点为平衡点,正逆速率相等,且T2反应速率快,说明温度高,则C点的正反应速率大于A点的逆反应速率;
③设起始二氧化硫的物质的量为2mol,氧气的物质的量为1mol
2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
起始物质的量 2 1 0
改变物质的量2x x 2x
平衡物质的量 2-2x 1-x 2x
则有(2-2x+1-x+2x)/(2+1)=0.07/0.1 解x=0.9,
平衡常数Kp=  =24300(MPa)-1 ;
=24300(MPa)-1 ;
(4) 现有由a mol NO、b molNO2、c molN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则产物中为硝酸钠或亚硝酸钠,氮原子和钠原子个数相等,则氮原子的物质的量为(a+b+2c)mol,则氢氧化钠的物质的量浓度最小为(a+b+2c)/V mol·L-1。


 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】按要求完成下列问题。
(1)利用VSEPR推断分子或离子的空间构型:![]() ___________;SeO3__________。
___________;SeO3__________。
(2)与SeO3互为等电子体的一种离子为_____(填化学式)。SCN-电子式_______。
(3)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是__。

(4)硒、溴与砷同周期,三种元素的第一电离能从大到小顺序为__________(用元素符号比较)。
(5) 已知常温下Ni(CO)4是无色液体,其构型为正四面体。则配位原子是______,晶体类型为__________,推测其______(填“难”或“易”)溶于水。
(6)CO2晶胞中,与CO2紧邻的CO2有_______个。
(7)酸性比较:H2SeO3______H2SeO4 ,原因_________________________________。
(8)向CuSO4溶液中滴加氨水,溶液先出现沉淀后沉淀溶解,写出沉淀溶解的离子方程式_____________________________,[Cu(H2O)4]2+易转化为[Cu(NH3)4]2+原因__________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C.J.Pedersen教授由于合成了冠醚而获得诺贝尔奖。这类醚因形似“王冠”故称冠醚。如

下列关于冠醚的说法正确的是
A. 冠醚属于烃类
B. (2)式与葡萄糖互为同分异构体
C. 冠醚能燃烧生成 CO2和H2O
D. (1)式和(2)式互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d为淡黄色的离子化合物,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是
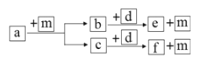
A. 原子半径: W<X<Y<Z
B. 阴离子的还原性: Y>W
C. 图中物质的转化过程均为氧化还原反应
D. a 一定由 W、X 两种元素组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科学家发现某药物M能治疗血管疾病,是因为它在人体内能释放出一种“信使分子”D,已知M的相对分子质量为227,由C、H、O、N四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%,则M的分子式是________________。D是双原子分子,相对分子质量为30,则D的分子式为________________。
(2)油脂A经下列途径可得到M:

图中②的提示:R—OH+HO—NO2![]() R—O—NO2+H2O(R代表烃基),反应②的化学方程式为___________________________________。
R—O—NO2+H2O(R代表烃基),反应②的化学方程式为___________________________________。
(3)C是B和乙酸在一定条件下反应生成的化合物,相对分子质量为134,写出C所有可能的结构简式___________________________________。
(4)若将0.1 mol B与足量的金属钠反应,则需消耗________ g金属钠。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g)开始进行时,CO的浓度为4 mol·L-1,N2的浓度为0,2 min后测得N2的浓度为0.6 mol·L-1,则此段时间内,下列反应速率表示正确的是
N2(g)+4CO2(g)开始进行时,CO的浓度为4 mol·L-1,N2的浓度为0,2 min后测得N2的浓度为0.6 mol·L-1,则此段时间内,下列反应速率表示正确的是
A. v(CO)=1.2 mol·L-1·s-1 B. v(NO2)=0.3 mol·L-1·min-1
C. v(N2)=0.6 mol·L-1·min-1 D. v(CO2)=1.2 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cl2制成漂粉精的主要目的是
A.使它转化为较稳定物质,便于保存和运输
B.增强漂白和消毒作用
C.使它转化为较易溶于水的物质
D.增加氯的质量分数,有利于漂白、消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L固定体积的容器中混合,并在一定条件下发生如下反应∶2A(g)+B(g)![]() 2C(g)。若经2s后测得C的浓度为0.6 mol L-1,现有下列几种说法,其中正确的是
2C(g)。若经2s后测得C的浓度为0.6 mol L-1,现有下列几种说法,其中正确的是
A.用物质A表示的反应的平均速率为0.6 mol (L s)-1
B.2 s时物质B的浓度为1.4 mol L-1
C.2 s时物质A的转化率为70%
D.2 s时物质A的体积分数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com