
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013届山东省济宁市泗水一中高三上学期期末模拟化学试卷(带解析) 题型:单选题
下列有关叙述正确的是
| A.高温下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应 |
B.实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g)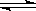 2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80% 2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80% |
| C.常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进 |
| D.向3mL0.1mol/LAgNO3溶液中滴入5滴0.1mol/L NaCl溶液产生白色沉淀,再滴入KI稀溶液沉淀显黄色,则KSP(AgI)<KSP(AgCl) |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市高三上学期期末模拟化学试卷(解析版) 题型:选择题
下列有关叙述正确的是
A.高温下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应
B.实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g)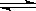 2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80%
2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80%
C.常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进
D.向3mL0.1mol/LAgNO3溶液中滴入5滴0.1mol/L NaCl溶液产生白色沉淀,再滴入KI稀溶液沉淀显黄色,则KSP(AgI)<KSP(AgCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数,下列有关叙述正确的是( )
A.56克铁与标准状况下22.4L氯气充分反应转移的电子数为2NA。
B.1L0.1mol/L乙酸溶液中的H+离子数为0.1NA。
C.常温下,1mol纯水中含有10-7NA个氢离子。
D.标准状况下,乙醇燃料电池负级消耗22.4L乙醇的分子时转移的电子数为12NA。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关叙述正确的是
A.高温下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应
B.实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH= - 196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80%
2SO3(g) ΔH= - 196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80%
C.常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进
D.向3mL0.1mol/LAgNO3溶液中滴入5滴0.1mol/L NaCl溶液产生白色沉淀,再滴入KI稀溶液沉淀显黄色,则KSP(AgI)<KSP(AgCl)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com