
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等):
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
则下列分析推理中不正确的是( )
|
| A. | 根据表中数据不能计算出混合物中NaHCO3的 |
|
| B. | 加入混合物9.2 g时盐酸过量 |
|
| C. | 盐酸的物质的量浓度为3.0 mol•L﹣1 |
|
| D. | 15.7 g混合物恰好与盐酸完全反应 |
| 钠的重要化合物;有关混合物反应的计算.. | |
| 专题: | 金属概论与碱元素. |
| 分析: | 由题意可知:9.2 g混合物与50 mL盐酸反应时盐酸过量,而27.6 g混合物与50 mL盐酸作用时盐酸不足; 由反应H++HCO3﹣=CO2↑+H2O知,盐酸的物质的量为:n(HCl)=n(CO2)=0.15 mol, 设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为x和y, 则有:x+y=0.1mol ① 84x+100y=9.2g ② 解得:x=0.05 mol,y=0.05 mol 所以c(HCl)=0.15 mol/0.05 L=3 mol/L, w(NaHCO3)= 又由n(NaHCO3)=n(KHCO3),84•n(NaHCO3)+100•n(KHCO3)=15.7g, 解得n (NaHCO3)=0.085 mol,所以15.7 g混合物完全反应消耗HCl的物质的0.17 mol>0.15 mol,故不能恰好完全反应. |
| 解答: | 解:A.第一组实验盐酸过量,固体完全反应,两成分中所含碳酸氢根的物质的量n(HCO3﹣)等于二氧化碳的物质的量,则84n(NaHCO3)+100[ B.由于第二组实验所得气体多于第一组实验,且盐酸同量,说明加入混合物9.2 g时盐酸过量,故B正确; C.由表知,最后一栏为盐酸不足,可根据生成气体的物质的量计算盐酸的浓度,c(HCl)= D.由分析可知n(NaHCO3)=n(KHCO3),84•n(NaHCO3)+100•n(KHCO3)=15.7g,解得n (NaHCO3)=0.085 mol,所以15.7 g混合物完全反应消耗HCl的物质的0.17 mol>0.15 mol,故不能恰好完全反应;或从前两组中的数据可以看出,二氧化碳的体积增加了 故选AD. |
| 点评: | 本题考查化合物的计算,侧重于学生数据分析能力和计算能力的考查,题目难度较大,本题注意比较三组数据,判断反应的程度,为解答该题的关键点,也是易错点,答题时注意体会. |


科目:高中化学 来源: 题型:
恒温恒容下,往一真空密闭容器中通入一定量的气体A,发生如下反应:2A(g)  B(g)+ xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
B(g)+ xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
A.若x=1,则p>a B.若x=2,则p < a
C.若x=3,则p=a D.若x=4,则p≥a
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 锌与稀硫酸反应:Zn+2H+=Zn2++H2↑ |
|
| B. | 碳酸钙与稀硝酸反应:CO32﹣+2H+=H2O+CO2↑ |
|
| C. | 氢氧化铝与盐酸反应:H++OH﹣=H2O |
|
| D. | 氯化镁溶液与氢氧化钠溶液反应:Mg2++OH﹣=Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于胶体的叙述不正确的是 ( )
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9 ~ 10-7m之间
B.光线透过胶体时,胶体中可发生丁达尔效应
C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)标准状况下,体积为11.2 L 的CO2的物质的量为 mol,
质量为 g,其所含原子的总数为 。
(2)能电离出6.02×1024个H+的H2SO4物质的量为 mol 。
(3)某金属氯化物为MCl2 9.5g,含有0.200molCl-,则该氯化物的摩尔质量为 g/mo,金属M的相对原子质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
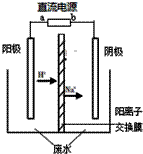 最近有研究人员发现了一种处理高浓度乙醛废水的新方法—隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如右图所示。下列说法正确的是
最近有研究人员发现了一种处理高浓度乙醛废水的新方法—隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如右图所示。下列说法正确的是
A.若以CH4—空气燃料电池为直流电源,燃料电池的b极应通入空气
B.电解过程中,阴极区Na2SO4的物质的量增大
C.阳极反应CH3CHO -2e- + 2H+== CH3COOH + H2O
D.电解过程中两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com