
下列离子方程式正确的是( )
|
| A. | 锌与稀硫酸反应:Zn+2H+=Zn2++H2↑ |
|
| B. | 碳酸钙与稀硝酸反应:CO32﹣+2H+=H2O+CO2↑ |
|
| C. | 氢氧化铝与盐酸反应:H++OH﹣=H2O |
|
| D. | 氯化镁溶液与氢氧化钠溶液反应:Mg2++OH﹣=Mg(OH)2↓ |
| 离子方程式的书写.. | |
| 专题: | 离子反应专题. |
| 分析: | A.锌与稀硫酸反应生成可溶性的硫酸锌和氢气; B.碳酸钙为难溶物,离子方程式中应该保留化学式; C.氢氧化铝为难溶物,离子方程式中需要保留化学式; D.离子方程式两边电荷必须守恒,该离子方程式两边电荷不相等. |
| 解答: | 解:A.锌与稀硫酸反应生成硫酸锌和氢气,反应的离子方程式为:Zn+2H+=Zn2++H2↑,故A正确; B.碳酸钙与稀硝酸反应,碳酸钙需要保留化学式,正确的离子方程式为:CaCO3+2H+=H2O+CO2↑+Ca2+,故B错误; C.氢氧化铝与盐酸反应生成氯化铝和水,氢氧化铝需要保留化学式,正确的离子方程式为:3H++Al(OH)3=3H2O+Al3+,故C错误; D.氯化镁溶液与氢氧化钠溶液反应,该离子方程式两边电荷不守恒,正确的离子方程式为:Mg2++2OH﹣=Mg(OH)2↓,故D错误; 故选A. |
| 点评: | 本题考查了离子方程式的书写正误判断,难度中等,注意掌握离子方程式的正确书写方法,明确常见难溶物、弱电解质、氧化物等需要保留化学式的物质;注意电荷守恒、质量守恒在判断离子方程式中的应用. |


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
右图是温度和压强对X + Y  2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中至多有一种是气态,Z必为气态
D.上述反应的逆反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质既能发生消去反应生成相应的烯烃,又能氧化成相应的醛的是
A.CH3OH B.CH2OHCH2CH3
C.(CH3)2COHCH3 D. (CH3)3COH
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年2月朝鲜进行了第三次核试验,引起国际社会的极大关注.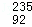 U是一种重要的核燃料,这里的“235”是指该原子的( )
U是一种重要的核燃料,这里的“235”是指该原子的( )
|
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等):
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
则下列分析推理中不正确的是( )
|
| A. | 根据表中数据不能计算出混合物中NaHCO3的 |
|
| B. | 加入混合物9.2 g时盐酸过量 |
|
| C. | 盐酸的物质的量浓度为3.0 mol•L﹣1 |
|
| D. | 15.7 g混合物恰好与盐酸完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。
该小组设计的简易实验装置如图所示:

该实验的主要操作步骤如下:
①配制100 mL 1.0 mol·L-1的盐酸溶液;
②用________(填仪器名称并注明规格)量取7.5mL 1.0 mol·L-1的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)步骤①中,配制100 mL 1.0 mol·L-1的盐酸溶液时,下列哪些操作会使配制浓度偏小(填写字母) 。
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯中有少量水
(2)请填写操作步骤中的空格:步骤②_______________ 步骤③___________
(3)实验步骤⑤中应选用__________(填字母)的量筒。
A.100 mL B.200 mL C.500 mL
(4)读数时除恢复到室温外,还要注意
①______________________________,②_________________________________。
(5)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm=____L/mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com