
超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:
Al2O3+N2+3C![]() 2AlN+3CO↑
2AlN+3CO↑
由于反应不完全,氮化铝产品中往往含有碳和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取20.00 g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气6.72 L(标准状况)。
①上述反应的化学方程式为_____________________________________________________;
②该产品中AlN的质量分数为_______________________________。
(2)另取10.00 g样品置于反应器中,通入2.016 L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34 g·L-1(已折算成标准状况,AlN不跟O2反应)。该产品中含杂质碳__________g。(此问需写出计算过程)
(1)①AlN+NaOH+H2O====NaAlO2+NH3↑
②61.5%
(2)m(C)=1.92 g 计算过程见解析。
(2)O2+2C![]() 2CO O2+C
2CO O2+C![]() CO2
CO2
![]() (气体)=1.34 g·L-1×22.4 L·mol-1=30.0 g·mol-1
(气体)=1.34 g·L-1×22.4 L·mol-1=30.0 g·mol-1
28<30.0<44
即Mr(CO)<![]() (气体)<Mr(CO2)
(气体)<Mr(CO2)
故反应后得到的气体是CO和CO2的混合气体。
设混合气体中CO2的物质的量为x,CO的物质的量为y。
2x+y=![]() ×2 (氧原子守恒)
×2 (氧原子守恒)
![]() =30.0 g·mol-1
=30.0 g·mol-1
解得:x=0.02 mol y=0.14 mol
所以:m(C)=12 g·mol-1×(0.02 mol+0.14 mol)=1.92 g


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:阅读理解
| 高温 |
| 4100a |
| 22.4w |
| 4100a |
| 22.4w |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)称取
①上述反应的化学方程式为_____________;?
②该样品中的AlN的质量分数为___________。?
(2)另取
查看答案和解析>>
科目:高中化学 来源: 题型:
Al2O3+![]() 2AlN+3CO
2AlN+3CO
由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质,为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取
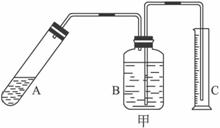
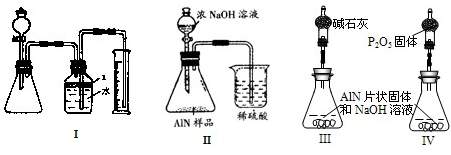
①上述反应的化学方程式为___________________________________。
②该样品中的AlN的质量分数为_______________。
③在装置B中所选择的试剂是________________(填序号)。
a.H2O b.浓H2SO
④上述实验方案,可能因气体体积测量不准,导致误差较大。有人建议改用下列乙、丙两个装置中的一种(在通风橱内进行),只需进行简单而又必要的数据测定,可比较准确地确定样品中AlN的质量分数。较合理的装置是___________(填代号)。
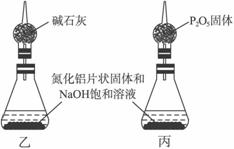
(2)另取
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com