
| A、30g甲醛(CH2O)与30g葡萄糖均含有NA个碳原子 |
| B、0.1molCl2与过量稀NaOH 溶液作用转移电子数0.2NA |
| C、常温下,1L pH=1的硫酸由水电离出的H+ 约为1×10-13NA |
| D、石墨电极电解CuSO4 溶液,阴极上有4mol电子转移,阳极上有NA个O2 |
| 30g |
| 30g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、CH3CH2COOH |
| B、CH3COOCH3 |
| C、HCOOCH2CH3 |
| D、HOCH2CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaI固体 |
| B、K2SO4固体 |
| C、NaOH固体 |
| D、HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用湿润的淀粉碘化钾试纸检验产物Q |
| B、K2FeO4在水中的电离方程式为K2FeO4═2K++Fe6++4O2一 |
| C、反应中氧化剂与还原剂的物质的量之比为1:8 |
| D、反应中涉及的6种物质均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,3.2gO2所含的原子数为0.2NA |
| B、常温下11.2L甲烷气体所含的分子数为0.5NA |
| C、18gD2O所含的电子数为10NA |
| D、1.5molNO2与足量水反应,转移的电子数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液与碳酸氢钠溶液反应:H++HCO3-=H2O+CO2↑ |
| B、铜与稀硝酸反应:Cu+4H++2NO3-=Cu2++NO2↑+2H2O |
| C、氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O |
| D、硫酸溶液与氢氧化钡溶液反应:H++SO42-+OH-+Ba2+=H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuSO4溶液能产生丁达尔效应 |
| B、分散质粒子的直径:浊液>胶体>溶液 |
| C、可以用过滤的方法除去氢氧化铁胶体中的可溶性杂质 |
| D、在饱和氯化铁溶液中滴加氢氧化钠溶液可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
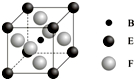 A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com