


科目:高中化学 来源: 题型:
| A、30g甲醛(CH2O)与30g葡萄糖均含有NA个碳原子 |
| B、0.1molCl2与过量稀NaOH 溶液作用转移电子数0.2NA |
| C、常温下,1L pH=1的硫酸由水电离出的H+ 约为1×10-13NA |
| D、石墨电极电解CuSO4 溶液,阴极上有4mol电子转移,阳极上有NA个O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgNO3 |
| B、FeSO4 |
| C、MgCl2 |
| D、(NH4)2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①②④ |
| C、②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol甲烷中含有10NA个质子 |
| B、27g铝被完全氧化成氧化铝,失去2NA个电子 |
| C、标准状况下,22.4 L苯含有NA个C6H6分子 |
| D、常温常压下,28g乙烯含有2NA个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )| A、⑥、⑧、⑨对应原子的半径依次减小 |
| B、②、⑦的最高价氧化物对应的水化物能相互反应 |
| C、元素⑩为Fe元素,处于常见周期表第四周期第VIIIB族 |
| D、①可分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||
| B、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| C、同周期元素(除0族元素外)从左到右,原子半径逐渐减小 | ||||
| D、若M+和R2-的核外电子层结构相同,则原子序数R>M |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在相同的条件下,2mol 氢气与 1 mol 氧气的总能量小于2mol 水蒸气的总能量 | ||
B、H2(g)+
| ||
| C、氢气燃烧是放热反应,所以氢气和氧气反应不需要其他外界条件即可发生 | ||
| D、任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
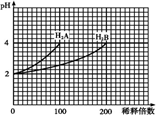 常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是( )
常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是( )| A、H2A为二元强酸 |
| B、pH=4的NaHA水溶液中离子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) |
| C、含NaHA、NaHB的混合溶液中,离子浓度大小为:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B) |
| D、Na2B的水溶液中,离子浓度大小为:c(Na+)>c(B2-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com