
【题目】按要求填空
①某烷烃B的结构简式为CH3CH(CH3)CH(C2H5),有一种烷烃C 与烷烃B 是同分异构体,它却不能由任何烯烃催化加氢得到,则C 的结构简式为______。
②烃![]() 与Br2加成时(物质的量之比为1: 1),所得产物可能有____种。
与Br2加成时(物质的量之比为1: 1),所得产物可能有____种。
③乙醛和足量银氨溶液反应的化学方程式__________。
④足量浓溴水与苯酚反应的化学方程式__________。
⑤1mol  与足量NaOH溶液反应,最多可消耗NaOH_______mol。
与足量NaOH溶液反应,最多可消耗NaOH_______mol。
【答案】 (CH3)3CC(CH3)3 5种 CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+H2O+3NH3+2Ag↓
CH3COONH4+H2O+3NH3+2Ag↓  3
3
【解析】①烷烃B的结构简式为CH3CH(CH3)CH(C2H5),烷烃C 与烷烃B 是同分异构体,C不能由相应的烯烃加氢得到,说明在C中任意相邻的两个碳原子,至少有一个没有氢原子,所以,C的结构简式为(CH3)3CC(CH3)3;②烃![]() 与Br2加成时(物质的量之比为1: 1),若为1,2加成,有三个碳碳双键,产物有三种;若1,4加成,则共轭二烯结构有两种(
与Br2加成时(物质的量之比为1: 1),若为1,2加成,有三个碳碳双键,产物有三种;若1,4加成,则共轭二烯结构有两种( 两个红圈里的结构分别为这两种共轭二烯的结构),产物有两种,故所得产物可能有5种;③乙醛和足量银氨溶液反应产生银镜,同时生成氨气、乙酸铵和水,反应的化学方程式为:CH3CHO+2Ag(NH3)2OH
两个红圈里的结构分别为这两种共轭二烯的结构),产物有两种,故所得产物可能有5种;③乙醛和足量银氨溶液反应产生银镜,同时生成氨气、乙酸铵和水,反应的化学方程式为:CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+H2O+3NH3+2Ag↓;④足量浓溴水与苯酚发生取代反应生成三溴苯酚和氢溴酸,反应的化学方程式为:
CH3COONH4+H2O+3NH3+2Ag↓;④足量浓溴水与苯酚发生取代反应生成三溴苯酚和氢溴酸,反应的化学方程式为: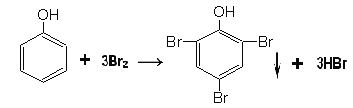 ;⑤
;⑤ 与NaOH溶液反应,卤原子在氢氧化钠的水溶液中加热水解以及酚能与氢氧化钠反应,故1mol
与NaOH溶液反应,卤原子在氢氧化钠的水溶液中加热水解以及酚能与氢氧化钠反应,故1mol  与足量NaOH溶液反应,最多可消耗3mol NaOH。
与足量NaOH溶液反应,最多可消耗3mol NaOH。


科目:高中化学 来源: 题型:
【题目】含氮的化合物广泛存在于自然界,是一类非常重要的化合物。回答下列问题:
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。己知该反应的相关的化学键键能数据如下:
化学键 | N≡N | H-O | N-H | O=O |
E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=________kJ/mol.
(2)在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)![]() 2N2O5(g)
2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示。“高温下,该反应能逆向自发进行,原因是___________________________。

②下列有关该反应的说法正确的是________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则砌氢化钠燃料电池的负极反应式为___________。

(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。上表是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为________________。
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II:2NO(g)+Cl2(g)![]() 2ClNO(g) K2
2ClNO(g) K2
①4NO(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应II达到平衡。测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=_____;其他条件不变,反应II在恒压条件下进行,平衡时NO的转化率α2___α1 (填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能说明发生了化学变化的是( )
A.变化时有电子的得失或共用电子对的形成
B.变化过程中有化学键的断裂和形成
C.变化时释放或吸收能量
D.变化前后原子的种类和数目没有改变,分子种类增加了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境污染已成为人类社会面临的重大威胁,各种污染数不胜数,下列名词与环境污染无关的是( )
①温室效应 ②赤潮 ③酸雨 ④光化学污染 ⑤臭氧层空洞 ⑥水俣病 ⑦潮汐 ⑧大脖子病
A.①②
B.⑦⑧
C.⑥⑦⑧
D.②⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中Mg元素只要以MgCl2的形式存在,海水提镁的主要流程如下:

(1)下列说法不正确的是___________。
A.试剂M是盐酸 B.生石灰在食品工业中常用于防潮剂
C.操作b只是过滤 D.MgCl2电解为Mg时,Mg2+得到的电子数为2NA
(2)沉淀池中的主要反应化学方程式为________________________________。
(3)为了得到纯净的Mg(OH)2,操作a是_________,实验室洗涤沉淀的具体操作是___________________。
(4)已知常温下Ca(OH)2溶解度为m 克,则饱和石灰水的质量分数为_____________(列出计算的表达式即可,下同),若饱和石灰水密度为1g/mL,则饱和石灰水溶液的物质的量浓度为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组设计如下实验方案,测定NaHCO3和Na2CO3混合物中NaHCO3的质量分数。按下图装置进行实验。并回答以下问题。

①按图组装仪器并检查装置的气密性。
②实验前称取17.90g样品,从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止, 从导管A处缓缓鼓入一定量的空气。
③实验结束后测得U型管增重 8.80g。
(1)B瓶中装的试剂为___________________,C装置的作用是___________________________。
(2)从导管A处缓缓鼓入一定量的空气的目的是_______________________。
(3)该样品中NaHCO3的质量分数为_______________________(保留三位有效数字)。
(4)现有等物质的量浓度的NaHCO3溶液和Na2CO3溶液各一瓶,请选择正确的方法进行鉴别____。
A.加热法:产生使澄清石灰水变浑浊气体的是NaHCO3
B.沉淀法:加入BaCl2溶液,产生沉淀的是Na2CO3溶液
C.气体法:逐滴加入盐酸,立即产生气泡的是NaHCO3溶液
D.测pH法:用pH试纸测其pH,pH大的是Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和酒精溶液 ②氯化钠和单质溴的水溶液 ③苯和氯化亚铁溶液,分离以上各混合液的正确方法依次是
A. 分液、萃取、蒸馏
B. 萃取、蒸发、分液
C. 分液、蒸馏、萃取
D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知葡萄糖的结构简式为CH2OH(CHOH)4CHO,由此判断下列关于葡萄糖性质的叙述中不正确的是( )
A.葡萄糖能发生酯化反应
B.葡萄糖具有还原性
C.葡萄糖充分燃烧的产物为CO2与H2O
D.完全燃烧等质量的葡萄糖和甲醛,所需氧气物质的量不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸. 
(1)B中Sn极上出现的现象
(2)C中Zn片上的电极反应式为;
(3)A、B、C中铁溶解的速率由快到慢的顺序是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com