
【题目】某校化学研究性学习小组设计如下实验方案,测定NaHCO3和Na2CO3混合物中NaHCO3的质量分数。按下图装置进行实验。并回答以下问题。

①按图组装仪器并检查装置的气密性。
②实验前称取17.90g样品,从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止, 从导管A处缓缓鼓入一定量的空气。
③实验结束后测得U型管增重 8.80g。
(1)B瓶中装的试剂为___________________,C装置的作用是___________________________。
(2)从导管A处缓缓鼓入一定量的空气的目的是_______________________。
(3)该样品中NaHCO3的质量分数为_______________________(保留三位有效数字)。
(4)现有等物质的量浓度的NaHCO3溶液和Na2CO3溶液各一瓶,请选择正确的方法进行鉴别____。
A.加热法:产生使澄清石灰水变浑浊气体的是NaHCO3
B.沉淀法:加入BaCl2溶液,产生沉淀的是Na2CO3溶液
C.气体法:逐滴加入盐酸,立即产生气泡的是NaHCO3溶液
D.测pH法:用pH试纸测其pH,pH大的是Na2CO3溶液
【答案】 浓H2SO4 防止空气中水蒸气、CO2进入U型管被吸收 把反应产生的CO2全部导入U形管中 70.4% BCD
【解析】由实验装置可知,从导管A处缓缓鼓入一定量的空气,先将装置中的二氧化碳排出,NaOH溶液可除去空气中的二氧化碳,锥形瓶中发生样品与硫酸的反应生成二氧化碳气体,B中应为浓硫酸干燥二氧化碳,U型管增重为反应生成二氧化碳的质量,干燥管中的碱石灰防止空气中的水蒸气、二氧化碳进入U型管中干扰含量的测定,则
(1)由上述分析可知B瓶中装的试剂为浓硫酸,C装置的作用是防止空气中水蒸气、CO2进入U型管被吸收;(2)导管A处缓缓鼓入一定量的空气的目的是把反应产生的CO2全部导入U形管中;(3)设NaHCO3和Na2CO3的质量分别为xg、yg,则x+y=17.90、x/84+y/106=8.8/44,两式联立解得x=12.6,因此该样品中NaHCO3的质量分数为12.60/17.90×100%=70.4%;A.加热法一般适用于鉴别碳酸钠和碳酸氢钠固体,A错误;B.加入BaCl2溶液,产生沉淀的是Na2CO3溶液,碳酸氢钠与氯化钡不反应,B正确;C.碳酸钠与盐酸反应分步进行,因此逐滴加入盐酸,立即产生气泡的是NaHCO3溶液,C正确;D.碳酸根的水解程度大于碳酸氢根,所以浓度相等时碳酸钠溶液的碱性强于碳酸氢钠,pH大,D正确,答案选BCD。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素。B、C、D均能与A形成10电子分子,E单质可用于焊接钢轨,F与D同主族,F与G同周期。
(1)D、E、F 的离子半径由大到小的顺序为_________(填离子符号)。
(2)写出能证明G比F非金属性强的一个离子方程式_____________。
(3)F和G的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2:1:6,甲的电子式为_______,该反应的化学方程式为___________________。
(4)C能分别与A和D按原子个数比1:2形成化合物乙和丙,乙的结构式为_______。常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QkJ,该反应的热化学方程式为_____________________。
(5)现取100mL 1mol/L的E的氯化物溶液,向其中加入1mol/L 氢氧化钠溶液产生了3.9g沉淀,则加入的氢氧化钠溶液体积可能为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,对下列事故或药品的处理正确的是( )
A. 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场
B. 金属钠着火燃烧时,用泡沫灭火器灭火
C. 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
D. 含硫酸的废液倒入水槽,用水冲入下水道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如图所示(已知A为单质):将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:

(1)红褐色胶体中F粒子直径大小的范围:___________________。
(2)写出A、B、H的化学式_____________、________、_________。
(3)①H2O2分子的电子式为_____________________。
②写出C的酸性溶液与双氧水反应的离子方程式:___________。
(4)鉴定E中阳离子时,可先加入_________溶液,再加热使之产生气体。
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
①某烷烃B的结构简式为CH3CH(CH3)CH(C2H5),有一种烷烃C 与烷烃B 是同分异构体,它却不能由任何烯烃催化加氢得到,则C 的结构简式为______。
②烃![]() 与Br2加成时(物质的量之比为1: 1),所得产物可能有____种。
与Br2加成时(物质的量之比为1: 1),所得产物可能有____种。
③乙醛和足量银氨溶液反应的化学方程式__________。
④足量浓溴水与苯酚反应的化学方程式__________。
⑤1mol  与足量NaOH溶液反应,最多可消耗NaOH_______mol。
与足量NaOH溶液反应,最多可消耗NaOH_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示: 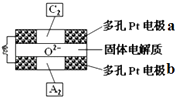
化合物 | 甲 | 乙 | 丙 | 丁 |
化学式 | A2C | A2C2 | D2C2 | D2E |
回答下列问题:
(1)指出元素F在周期表中的位置 .
(2)化合物乙的电子式为 , 用电子式表示形成化合物丁的过程
(3)写出丙与甲反应的离子方程式: .
(4)固体氧化物燃料电池是以固体氧化锆﹣氧化钇为电解质,这种固体电解质在高温下允许O2﹣在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体.该电池的负极为(填a或b);O2﹣流向极(填“正”或“负”);该电池的正极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A→B、B→C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是

A. 两步反应均为吸热反应 B. 三种化合物中C最稳定
C. 加入催化剂会改变反应的焓变 D. 整个反应的ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为探究金属Al在酸性或碱性溶液中均可与NO3-发生氧化还原反应,进行如下实验:
①将Al加入到pH=2的HNO3溶液中,Al溶解,得到溶液A,产生无色气体C,气体C在空气中转化为红棕色气体E;
②将Al 加入到pH=12的KNO3和KOH混合溶被中,Al溶解,得到溶液B,产生无色有刺激性气味的气体D;
③在A溶液中通入气体D,最终产生大量的白色沉淀;
④在B溶液中通入气体E,先出现白色沉淀,而后白色沉淀溶解。
请回答下列问题:
(1)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是_______。
(2)E和D在一定条件下反应生成两种对环境无污染的物质,则该反应的化学方程式为_______。
(3)已知A和B两溶液混合产生白色沉淀,该反应的离子方程式为_______。
(4)以Al和Fe作电极,在碱性、NO3-存在条件下形成原电池,则Fe电极反应式为_______。
(5)除去气体C中混有的少量E的操怍是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com