
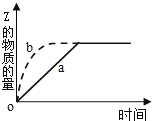
【题目】如图曲线a表示可逆反应X(g)+Y(g)Z(g)+M(g).进行过程中Z的物质的量随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A.压缩反应容器的体积
B.加入一定量的Z
C.降低温度
D.减少X的投入量
【答案】A
【解析】
试题分析:由图象可知,由曲线a到曲线b,到达平衡的时间缩短,改变条件,反应速率加快,且平衡时Z的物质的量不变,说明条件改变不影响平衡状态的移动,据此结合选项判断.
解:由图象可知,由曲线a到曲线b,到达平衡的时间缩短,改变条件,反应速率加快,且平衡时Z的物质的量不变,说明条件改变不影响平衡状态的移动,
A.压缩容器体积,增大了压强,反应速率加快,由于该反应是气体体积不变的反应,则达到平衡时Z的物质的量不变,该变化与图象曲线变化一致,故A正确;
B.加入一定量的Z,平衡时Z的物质的量会偏大,故B错误;
C.该反应正反应是放热反应,降低温度,反应速率减慢,平衡向正反应移动,Z的物质的量减小,故C错误;
D.减少X的投入量,反应物浓度减小,反应速率会减小,故D错误;
故选A.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Fe3O4是重要的化学试剂,其化学式还可以表示为FeO·Fe2O3,铁粉在氧气中燃烧是制取它最为常见和快捷的方法。图1是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。

(1)图2中仪器a的名称是_____________________。
(2)根据题目要求,在图2中最好选择_____________(填序号)作为A装置。
(3)对图2中装置②进行气密性检查的方法是__________________________。
(4)在B装置中发生的主要反应的化学方程式是___________________________。
(5)反应一段时间后,若将硬质玻璃管中的固体粉末用盐酸溶解,取少许溶液于试管中,加入淀粉碘化钾溶液,没有蓝色出现,推测固体粉末中除Fe3O4外,一定有____________(填名称)。
(6)写出Fe3O4溶于足量稀硫酸的离子方程式_______________,要检验所得溶液中的Fe3+,常用试剂是____________(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图中的简易装置可以进行气体的发生和收集。

(1)实验前应如何检查该装置的气密性?
(2)拨开试管a的橡皮塞,加入10ml6mol·L-1稀HNO3和1g薄铜片,立即将带有导管的橡皮塞塞紧试管口,反应开始时速度缓慢,逐渐加快,请写出试管a中所发生的所有反应的方程式。
(3)从反应开始到反应结束,预期试管a中可观察到哪些现象?请依次逐一写出。
(4)在反应开始时,可观察到导管b中的水面先沿导管b慢慢上升到一定高度,此后又回落,然后有气泡从管口冒出。试说明反应开始时,导管中水面先上升的原因。
(5)试管c收集满气体后,用拇指堵住管口,取出水槽,将管口向上,松开拇指,片刻后,再次堵住管口,将试管又再倒置于水槽中,松开拇指,此时可观察到什么现象?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )

A.该反应的化学方程式为3B+4D6A+2C
B.反应进行到1s时,v(A)=v(C)
C.反应进行到6s时,B和D的物质的量浓度均为0.4molL﹣1
D.反应进行到6s时,B的平均反应速率为0.05mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
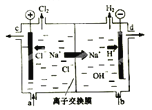
完成下列填空:
(1).写出电解饱和食盐水的离子方程式 。
(2).离子交换膜的作用为: 、 。
(3).精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
(4).KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)通入氢气的电极为 (填“正极”或“负极”),负极的电极反应式为 。
(2)石墨电极为 (填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液 区(填“铁极”或“石墨极”)的溶液先变红。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将 ,填“增大”“减 小”或“不变”)。精铜电极上的电极反应式为 。
(4)假设乙装置中氯化钠溶液足够多,若在标准状况下,有224mL氧气参加反应,则乙装置中阳离子交换膜左侧溶液质量将 ,(填“增大”“减 小”或“不变”),且变化了 克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )
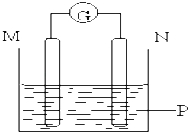
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,把3.0molM和2.5molN混合于2.0L的密闭容器中,发生反应的化学方程式为:3M(g)+N(g)![]() xP(g)+2Q(g) ,5min后反应达到平衡,容器内的压强变小,已知Q的平均反应速率为0.10 molL-1min-1,下列说法错误的是( )
xP(g)+2Q(g) ,5min后反应达到平衡,容器内的压强变小,已知Q的平均反应速率为0.10 molL-1min-1,下列说法错误的是( )
A.x的值为1 B.M的平均反应速率为0.15 molL-1min-1
C.M的转化率为60% D.平衡时p的浓度为0.25 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。
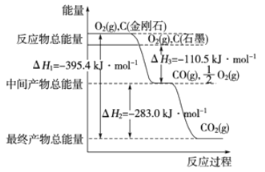
(1)在通常状况下,金刚石和石墨 (填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式 。
(2)12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量 。
(3)已知在常温常压下:
①CH3OH(l)+O2(g)=CO(g)+2H2O(g) △H=-359.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-556.0kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com